题目内容
2.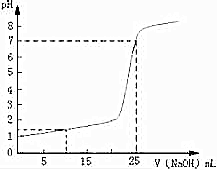 常温下,将一定浓度的NaOH溶液逐滴加入到20.00mL一定物质的量浓度的硫酸溶液中,反应过程中溶液pH和所加NaOH溶液的体积关系如图所示:
常温下,将一定浓度的NaOH溶液逐滴加入到20.00mL一定物质的量浓度的硫酸溶液中,反应过程中溶液pH和所加NaOH溶液的体积关系如图所示:(1)由图可知,硫酸的物质的量浓度为多少?
(2)计算NaOH溶液的物质的量浓度:
(3)计算加入10mLNaOH溶液时,溶液的pH(已知1g2=0.3,混合后溶液的体积按混合前两种溶液的体积之和计算)
分析 (1)由图可知,在加入NaOH之前,pH=1,根据c(H+)计算硫酸的浓度;
(2)当加到25mL的NaOH时pH=7,氢氧化钠与硫酸恰好完全中和,根据n(H+)=n(OH-)计算;
(3)加入10mLNaOH后,总体积V=10+20=30mL,中和掉H+为0.08×0.01=0.0008mol,剩余的H+为0.1×0.02-0.008=0.0012moL,然后计算氢离子浓度和pH.
解答 解:(1)由图可知,在加入NaOH之前,硫酸溶液的pH=1,则c(H+)=0.1mol/L,所以硫酸的浓度为c(H2SO4)=$\frac{1}{2}$c(H+)=0.05mol/L;
答:硫酸的物质的量浓度为0.05mol/L;
(2)当加到25mL的NaOH时pH=7,氢氧化钠与硫酸恰好完全中和,而由(1)可知,c(H+)=0.1mol/L,所以n(H+)=c(H+)×V(H2SO4)=n(OH-)=c(NaOH)×V(NaOH),
所以c(NaOH)=$\frac{0.1mol/L×0.02L}{0.025L}$=0.08mol/L;
答:NaOH溶液的物质的量浓度为0.08mol/L;
(3)加入10mLNaOH后,总体积V=10+20=30mL,中和掉H+为0.08×0.01=0.0008mol,剩余的H+为0.1×0.02-0.008=0.0012moL,所以最后c(H+)=$\frac{0.0012mol}{0.03L}$=0.04mol/L,
所以pH=-lgc(H+)=-lg0.04=1.4;
答:加入10mLNaOH溶液时,溶液的pH为1.4.
点评 本题考查了酸碱混合溶液的定量计算、pH的计算,题目难度中等,注意把握混合溶液中离子浓度的计算方法,侧重于考查学生的分析能力和计算能力.

 阅读快车系列答案
阅读快车系列答案| A. | 1 mol H2中含有6.02×1023个H | B. | 1 mol氧含有6.02×1023个O2 | ||
| C. | 1 mol CaCl2溶液里含有1 mol离子 | D. | 1 mol H+中含有H+数为NA |
①加H2O
②加NaOH固体
③加CH3COONa固体
④加Na2CO3固体
⑤加入NaNO3固体
⑥加NaCl溶液
⑦滴入几滴硫酸铜溶液
⑧升高温度
⑨将块状铁改为铁粉
⑩将稀硫酸改用98%的浓硫酸.
| A. | ⑧⑨⑩ | B. | ⑦⑧⑨ | C. | ③⑦⑩ | D. | ⑦⑧⑩ |
| A. | 胶体的分散质能透过滤纸 | B. | 胶体粒子直径在1nm~100nm之间 | ||
| C. | 胶体具有丁达尔现象 | D. | 胶体和其它分散系都是混合物 |
| A. | 葡萄糖与银氨溶液反应会产生银镜现象 | |
| B. | 生吃新鲜蔬菜要比熟吃时维生素C的损失小 | |
| C. | 油脂在人体内酶的催化作用下水解为氨基酸 | |
| D. | 不慎误食重金属盐离子,应立即喝大量牛奶来缓解毒性,以减少人体蛋白质中毒的程度 |
| 编号 | 热化学方程式 |
| ① | CO(g)+2H2(g)?CH3OH(g)△H1=-99kJ•mol-1 |
| ② | 2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-24kJ•mol-1 |
| ③ | CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41kJ•mol-1 |
(1)该工艺的总反应为3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)△H
该反应△H=-245.6kJ/mol,化学平衡常数的表达式K=K=K12.K2.K3
(2)普通工艺中反应①和反应②分别在不同的反应器中进行,无反应③发生.该工艺中反应③的发生提高了CH3OCH3的产率,原因是反应③消耗了反应②中的产物H2O,使反应②的化学平衡向正反应方向移动.
(3)以$\frac{n({H}_{2})}{n(CO)}$=2通入1L的反应器中,一定条件下发生反应:4H2(g)+2CO(g)?CH3OCH3(g)+H2O(g)△H,
其CO的平衡转化率随温度、压强变化关系如图所示:
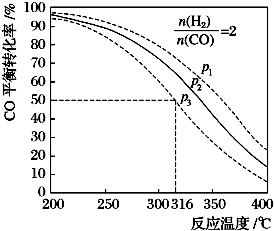
则该反应的△H<0(填“>”或“<”或“=”),在P3和316℃反应达到平衡时,H2的转化率等于50%,图中压强的大小关系为P1>P2>P3,理由是增大压强平衡正向移动CO转化率增大.
(4)以二甲醚(CH3OCH3)为原料设计电池,一个电极通入空气,另一个电极通入二甲醚蒸气,KOH溶液为电解质,则该电池的负极反应式为CH3OCH3-12e-+16OH -=2CO32-+11H2O .