题目内容
7.同温同压下,有两瓶体积相等的CO和CO2,这两种气体中所含的分子数目之比为1:1,所含的O原子数目之比为1:2,所含的原子总数目之比为2:3,所含的电子数目之比为7:11,质量比为7:11.分析 同温同压下,体积相等的气体具有相同的物质的量,根据N=nNA计算出两种气体中所含的分子数目、O原子、原子总数、电子数之比;根据m=nM计算出二者的质量之比.
解答 解:同温同压下,气体摩尔体积相等,两瓶体积相等的CO和CO2的物质的量相等,这两种气体中所含的分子数目之比=物质的量之比=1:1,含有O原子数目之比=(1×1):(1×2)=1:2,含有原子总数之比=(1×2):(1×3)=2:3,含有电子数之比=(1×14):(1×22)=7:11;物质的量相等时二者质量之比=摩尔质量之比=28g/mol:44g/mol=7:11,
故答案为:1:1;1:2; 2:3;7:11;7:11.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量与气体摩尔体积、阿伏伽德罗常数、摩尔质量之间的关系即可解答,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
17.在浓盐酸中H3AsO3与SnCl2反应的离子方程式为:3SnCl2+12Cl-+2H3AsO3+6H+═2As+3SnCl62-+6M,关于该反应的说法中正确的组合是( )
①氧化剂是H3AsO3 ②还原性:Cl->As ③M为OH- ④SnCl62-是氧化产物
⑤每生成7.5g As(As的相对原子质量为75),还原剂失去的电子为0.3mol.
①氧化剂是H3AsO3 ②还原性:Cl->As ③M为OH- ④SnCl62-是氧化产物
⑤每生成7.5g As(As的相对原子质量为75),还原剂失去的电子为0.3mol.
| A. | ①④⑤ | B. | ①③⑤ | C. | ①②③ | D. | ①②③④⑤ |
18.下列反应类型:①酯化、②取代、③消去、④加成、⑤水解、⑥还原,可能在有机物分子中引入羟基的是( )
| A. | ①②③⑥ | B. | ②④⑤⑥ | C. | ②④⑥ | D. | ②③④ |
15.某有机物其结构简式为 ,关于该有机物下列叙述正确的是( )
,关于该有机物下列叙述正确的是( )
 ,关于该有机物下列叙述正确的是( )
,关于该有机物下列叙述正确的是( )| A. | 不能使酸性KMnO4溶液褪色 | |
| B. | 在加热和催化剂作用下,最多能和5mol H2反应 | |
| C. | 能使溴水褪色 | |
| D. | 一定条件下,能和NaOH醇溶液反应 |
12.下列关于电解质的判断中,正确的观点是( )
| A. | 在熔融状态下能导电的物质 | |
| B. | 在熔融或溶解状态下能导电的物质 | |
| C. | 在溶解或熔融状态下能导电的化合物 | |
| D. | 在熔融和溶液的状态下都能导电的化合物 |
19.在密闭容器中,一定条件下,进行如下反应:NO(g)+CO(g)?$\frac{1}{2}$N2(g)+CO2(g)△H=-373.2kJ/mol,达到平衡后,为提高该反应的速率和CO的转化率,采取的正确措施是( )
| A. | 加催化剂同时升高温度 | B. | 升高温度同时充入N2 | ||
| C. | 加催化剂同时增大压强 | D. | 降低温度同时减小压强 |
4.增强环保意识.爱护环境是每个公民的职责.利用碳的氧化物合成甲醇等资源化利用对环境保护具有重要意义.请回答下列问题:
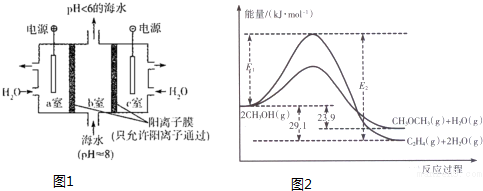
(1)溶于海水的CO2有4种存在形式.其中HCO3-占95%,除上述两种形式外,碳的存在形式还有H2CO3、CO32- (填微粒符号);利用图1装置进行的实验中,a室的电极反应式为2H2O-4e-=O2↑+4H+或4OH--4e-=2H2O+O2↑.
(2)下列为合成甲醇的有关化学方程式
①2H2(g)+CO(g)?CH3OH(g)
②H2(g)+CO2(g)?H2O(g)+CO(g)
③3H2(g)+CO2(g)?CH3OH(g)+H2O(g)
某温度下,上述三个反应的平衡常数数值分别为2.5,2.0和K3,则K3值为5.0.
(3)一定条件下,甲醇可同时发生:
A.2CH3OH(g)═CH3OCH3+H2O(g)
B.2CH3OH(g)═C2H4(g)+2H2O(g).
上述反应过程中能量变化如图2所示:
①写出反应速率较大的序号并说明原因A;该反应的活化能较小,在相同条件下反应速率较大.
②若在容器中加入催化剂,则E2-E1将不变〔填“变大”、“不变”或“变小”〕.
(4)一定温度时,容积相同的甲、乙、丙三个恒容密闭容器中,按不同方式投入反应物,发生反应2H2(g)+CO(g)?CH3OH(g)△H=-90kJ/mol,测得达平衡时的有关数据如下表:
①表中数据存在的关系为:|Q1|+|Q2|=90(填>、=或<,下同).2c2<c3.
②在温度不变、恒容条件下,该反应的平衡常数数值Kp=4.80×10-2,若甲容器中反应达平衡状态时,p(CH3OH)=24.0kPa,则平衡时,混合气体中CH3OH的物质的量分数为61.5% (Kp是用平衡分压代替平衡浓度所得的平衡常数,分压=总压×物质的量分数).
(1)溶于海水的CO2有4种存在形式.其中HCO3-占95%,除上述两种形式外,碳的存在形式还有H2CO3、CO32- (填微粒符号);利用图1装置进行的实验中,a室的电极反应式为2H2O-4e-=O2↑+4H+或4OH--4e-=2H2O+O2↑.

(2)下列为合成甲醇的有关化学方程式
①2H2(g)+CO(g)?CH3OH(g)
②H2(g)+CO2(g)?H2O(g)+CO(g)
③3H2(g)+CO2(g)?CH3OH(g)+H2O(g)
某温度下,上述三个反应的平衡常数数值分别为2.5,2.0和K3,则K3值为5.0.
(3)一定条件下,甲醇可同时发生:
A.2CH3OH(g)═CH3OCH3+H2O(g)
B.2CH3OH(g)═C2H4(g)+2H2O(g).
上述反应过程中能量变化如图2所示:
①写出反应速率较大的序号并说明原因A;该反应的活化能较小,在相同条件下反应速率较大.
②若在容器中加入催化剂,则E2-E1将不变〔填“变大”、“不变”或“变小”〕.
(4)一定温度时,容积相同的甲、乙、丙三个恒容密闭容器中,按不同方式投入反应物,发生反应2H2(g)+CO(g)?CH3OH(g)△H=-90kJ/mol,测得达平衡时的有关数据如下表:
| 容器 | 甲 | 乙 | 丙 | |
| 起始反应物投入量 | 2molH2(g) 1molCO(g) | 1mol CH3OH(g) | 2mol CH3OH(g) | |
| 平衡 | c(CH3OH)/mol/•L-1 | c1 | c2 | c3 |
| 反应的能量变化/KJ | Q1 | Q2 | Q3 | |
②在温度不变、恒容条件下,该反应的平衡常数数值Kp=4.80×10-2,若甲容器中反应达平衡状态时,p(CH3OH)=24.0kPa,则平衡时,混合气体中CH3OH的物质的量分数为61.5% (Kp是用平衡分压代替平衡浓度所得的平衡常数,分压=总压×物质的量分数).
5.下列化学用语表达正确的是( )
| A. | F-的原子结构示意图: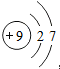 | B. | 乙烯的结构简式:CH2CH2 | ||
| C. | 葡萄糖的分子式:C6H12O6 | D. | 二氧化碳的电子式: |
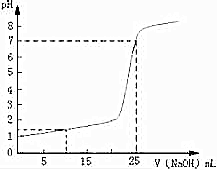 常温下,将一定浓度的NaOH溶液逐滴加入到20.00mL一定物质的量浓度的硫酸溶液中,反应过程中溶液pH和所加NaOH溶液的体积关系如图所示:
常温下,将一定浓度的NaOH溶液逐滴加入到20.00mL一定物质的量浓度的硫酸溶液中,反应过程中溶液pH和所加NaOH溶液的体积关系如图所示: