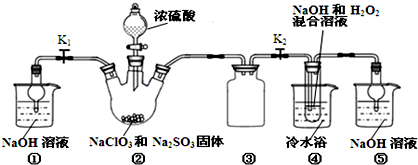
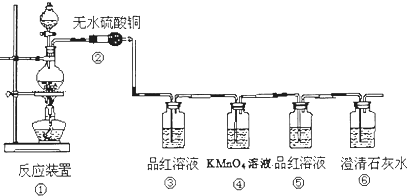
题目内容
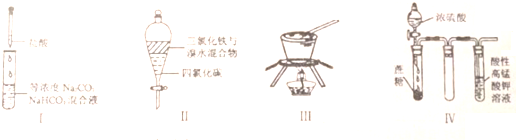 下列由相关图象作出的描述正确的是( )
下列由相关图象作出的描述正确的是( )| A、实验Ⅰ:滴加稀盐酸,NaHCO3先反应立即产生大量气泡 |
| B、实验Ⅱ:振荡后静置分层,上层无色溶液从上口倒出 |
| C、实验Ⅲ:从饱和硫酸钠溶液中提取硫酸钠晶体 |
| D、装置Ⅳ:酸性KMnO4溶液中出现气泡,溶液颜色逐渐褪去 |
考点:化学实验方案的评价
专题:实验评价题
分析:A.先发生碳酸钠与盐酸的反应生成碳酸氢钠;
B.上层为氯化铁溶液,为黄色;
C.从饱和硫酸钠溶液中提取硫酸钠晶体,利用蒸发操作;
D.浓硫酸具有脱水性,蔗糖变为C,然后与浓硫酸反应生成二氧化硫,具有还原性,使酸性KMnO4溶液褪色.
B.上层为氯化铁溶液,为黄色;
C.从饱和硫酸钠溶液中提取硫酸钠晶体,利用蒸发操作;
D.浓硫酸具有脱水性,蔗糖变为C,然后与浓硫酸反应生成二氧化硫,具有还原性,使酸性KMnO4溶液褪色.
解答:
解:A.先发生碳酸钠与盐酸的反应生成碳酸氢钠,则开始没有气泡,故A错误;
B.四氯化碳的密度比水的大,充分振荡后静置,下层溶液为橙红色,上层为氯化铁溶液,为黄色,故B错误;
C.从饱和硫酸钠溶液中提取硫酸钠晶体,利用蒸发操作,不需要坩埚,应选蒸发皿,故C错误;
D.浓硫酸具有脱水性,蔗糖变为C,然后与浓硫酸反应生成二氧化硫,具有还原性,使酸性KMnO4溶液褪色,观察到性KMnO4溶液中有气泡出现,且溶液颜色会逐渐变浅乃至褪去,故D正确;
故选D.
B.四氯化碳的密度比水的大,充分振荡后静置,下层溶液为橙红色,上层为氯化铁溶液,为黄色,故B错误;
C.从饱和硫酸钠溶液中提取硫酸钠晶体,利用蒸发操作,不需要坩埚,应选蒸发皿,故C错误;
D.浓硫酸具有脱水性,蔗糖变为C,然后与浓硫酸反应生成二氧化硫,具有还原性,使酸性KMnO4溶液褪色,观察到性KMnO4溶液中有气泡出现,且溶液颜色会逐渐变浅乃至褪去,故D正确;
故选D.
点评:本题考查实验方案的评价,涉及到反应的先后顺序、萃取、蒸发等知识点,属于常见的冷拼试题,考查点较多,学生应注意思维的及时转换来解答,D选项难度较大.

练习册系列答案
相关题目
常温下,现有NaCl和CuSO4的混合溶液,用Pt电极电解,当电路中通过0.4mol电子的电量时,阴阳两极都产生0.15mol的气体,若电解后溶液体积为10L,则电解后溶液的pH为( )
| A、2 | B、5 | C、9 | D、12 |
下列说法正确的是( )
| A、1molO2和1molN2所占的体积都约为22.4L | ||
B、30% 氨水物质的量浓度为c,稀释至15%后,物质的量浓度比
| ||
| C、等质量的NO2和N2O4所含原子数一定相等 | ||
| D、等体积、等物质的量浓度的强酸溶液中所含的H+离子数一定相等 |
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A、标准状况下,11.2 L Cl2通入含0.5molFeBr2的溶液中转移电子数为1.5NA |
| B、0.1 mol?L-1的AlCl3溶液与足量NaOH溶液反应所得产物中含AlO2-为0.1NA |
| C、足量Zn与浓硫酸共热可生成标准状况下的气体2.24 L,则参加反应的硫酸为0.4 NA |
| D、常温常压下,5.6g环丙烷和聚乙烯的混合物中含有的碳原子数为0.4NA |