题目内容
硫代硫酸钠(Na2S2O3)具有较强的还原性,还能与中强酸反应,在精细化工领域应用广泛.将SO2通入按一定比例配制成的Na2S和Na2CO3的混合溶液中,可制得Na2S2O3?5H2O(大苏打).
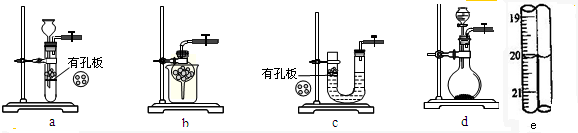
(1)实验室用Na2SO3和硫酸制备SO2,可选用的气体发生装置是 (选填编号);检查该装置气密性的操作是:关闭止水夹,再 .
(2)在Na2S和Na2CO3的混合溶液中不断通入SO2气体的过程中,发现:
①浅黄色沉淀先逐渐增多,反应的化学方程式为 (生成的盐为正盐);
②浅黄色沉淀保持一段时间不变,有无色无嗅的气体产生,则反应的化学方程式为 (生成的盐为正盐);
③浅黄色沉淀逐渐减少(这时有Na2S2O3生成);
④继续通入SO2,浅黄色沉淀又会逐渐增多,反应的化学方程式为 (生成的盐为酸式盐).
(3)制备Na2S2O3时,为了使反应物利用率最大化,Na2S和Na2CO3的物质的量之比应为 ;通过反应顺序,可比较出:温度相同时,同物质的量浓度的Na2S溶液和Na2CO3溶液pH更大的是 .
(4)硫代硫酸钠的纯度可用滴定法进行测定,原理是:2S2O32-+I3-→S4O62-+3I-.
①为保证不变质,配制硫代硫酸钠溶液须用新煮沸并冷却的蒸馏水,其理由是 .
②取2.500g含杂质的Na2S2O3?5H2O晶体配成50mL溶液,每次取10.00mL用0.0500mol/L KI3溶液滴定(以淀粉为指示剂),实验数据如下(第3次初读数为0.00,终点读数如图e;杂质不参加反应):
到达滴定终点的现象是 ;Na2S2O3?5H2O(式量248)的质量分数是(保留4位小数) .

(1)实验室用Na2SO3和硫酸制备SO2,可选用的气体发生装置是
(2)在Na2S和Na2CO3的混合溶液中不断通入SO2气体的过程中,发现:
①浅黄色沉淀先逐渐增多,反应的化学方程式为
②浅黄色沉淀保持一段时间不变,有无色无嗅的气体产生,则反应的化学方程式为
③浅黄色沉淀逐渐减少(这时有Na2S2O3生成);
④继续通入SO2,浅黄色沉淀又会逐渐增多,反应的化学方程式为
(3)制备Na2S2O3时,为了使反应物利用率最大化,Na2S和Na2CO3的物质的量之比应为
(4)硫代硫酸钠的纯度可用滴定法进行测定,原理是:2S2O32-+I3-→S4O62-+3I-.
①为保证不变质,配制硫代硫酸钠溶液须用新煮沸并冷却的蒸馏水,其理由是
②取2.500g含杂质的Na2S2O3?5H2O晶体配成50mL溶液,每次取10.00mL用0.0500mol/L KI3溶液滴定(以淀粉为指示剂),实验数据如下(第3次初读数为0.00,终点读数如图e;杂质不参加反应):
| 编号 | 1 | 2 | 3 |
| 消耗KI3溶液的体积/mL | 19.98 | 20.02 |
考点:制备实验方案的设计
专题:实验题
分析:(1)因为Na2SO3易溶于水,a、b、c装置均不能选用,实验室用Na2SO3和硫酸制备SO2,可选用的气体发生装置是d;关闭止水夹,若气密性很好,则分液漏斗中水不能滴入烧瓶中;
(2)①其反应原理为SO2+Na2S+H2O=H2S+Na2SO3,2H2S+SO2=3S↓+2H2O,即:3SO2+2Na2S=3S↓+2Na2SO3;
②无色无味的气体为CO2气体,其化学方程式为SO2+Na2CO3=Na2SO3+CO2;
③黄色沉淀减少的原理为Na2SO3+S=Na2S2O3;
④根据题意Na2S2O3能与中强酸反应,所以浅黄色沉淀又增多的原理为Na2S2O3+SO2+H2O=S↓+2NaHSO3;
(3)3SO2+2Na2S=3S↓+2Na2SO3①
SO2+Na2CO3=Na2SO3+CO2②
Na2SO3+S=Na2S2O3③
①+②+③×3得
4SO2+2Na2S+Na2CO3=3Na2S2O3+CO2;
所以Na2S和Na2CO3的物质的量之比为2:1.
因为SO2先和Na2S反应,所以温度相同时,同物质的量浓度的Na2S溶液和Na2CO3溶液,Na2S溶液的pH更大;
(4)①用新煮沸并冷却的蒸馏水是为了赶出水中的氧气避免硫代硫酸钠被氧化;
②达到滴定终点时颜色突变且30s不变色;先根据滴定消耗的标准液的体积计算出平均体积,再由2S2O32-+I3-→S4O62-+3I-,的定量关系计算.
(2)①其反应原理为SO2+Na2S+H2O=H2S+Na2SO3,2H2S+SO2=3S↓+2H2O,即:3SO2+2Na2S=3S↓+2Na2SO3;
②无色无味的气体为CO2气体,其化学方程式为SO2+Na2CO3=Na2SO3+CO2;
③黄色沉淀减少的原理为Na2SO3+S=Na2S2O3;
④根据题意Na2S2O3能与中强酸反应,所以浅黄色沉淀又增多的原理为Na2S2O3+SO2+H2O=S↓+2NaHSO3;
(3)3SO2+2Na2S=3S↓+2Na2SO3①
SO2+Na2CO3=Na2SO3+CO2②
Na2SO3+S=Na2S2O3③
①+②+③×3得
4SO2+2Na2S+Na2CO3=3Na2S2O3+CO2;
所以Na2S和Na2CO3的物质的量之比为2:1.
因为SO2先和Na2S反应,所以温度相同时,同物质的量浓度的Na2S溶液和Na2CO3溶液,Na2S溶液的pH更大;
(4)①用新煮沸并冷却的蒸馏水是为了赶出水中的氧气避免硫代硫酸钠被氧化;
②达到滴定终点时颜色突变且30s不变色;先根据滴定消耗的标准液的体积计算出平均体积,再由2S2O32-+I3-→S4O62-+3I-,的定量关系计算.
解答:
解:(1)因为Na2SO3易溶于水,a、b、c装置均不能选用,实验室用Na2SO3和硫酸制备SO2,可选用的气体发生装置是d;检查该装置气密性的操作是:关闭止水夹,若气密性很好,则分液漏斗中水不能滴入烧瓶中;
故答案为:d;打开分液漏斗活塞加水,如水无法滴入说明气密性良好;
(2)①浅黄色沉淀先逐渐增多,其反应原理为SO2+Na2S+H2O=H2S+Na2SO3,2H2S+SO2=3S↓+2H2O,即反应的化学方程式为:3SO2+2Na2S=3S↓+2Na2SO3;
故答案为:3SO2+2Na2S=3S↓+2Na2SO3;
②浅黄色沉淀保持一段时间不变,有无色无嗅的气体产生,则反应的化学方程式为,无色无味的气体为CO2气体,其化学方程式为SO2+Na2CO3=Na2SO3+CO2;
故答案为:SO2+Na2CO3=Na2SO3+CO2;
③浅黄色沉淀逐渐减少,这时有Na2S2O3生成黄色沉淀,减少的原理为:Na2SO3+S=Na2S2O3,故答案为:Na2SO3+S=Na2S2O3;
④根据题意Na2S2O3能与中强酸反应,继续通入SO2,浅黄色沉淀又会逐渐增多,所以浅黄色沉淀又增多的原理为:Na2S2O3+SO2+H2O=S↓+2NaHSO3;
故答案为:Na2S2O3+SO2+H2O=S↓+2NaHSO3;
(3)3SO2+2Na2S=3S↓+2Na2SO3①
SO2+Na2CO3=Na2SO3+CO2②
Na2SO3+S=Na2S2O3③
①+②+③×3得
4SO2+2Na2S+Na2CO3=3Na2S2O3+CO2;
所以Na2S和Na2CO3的物质的量之比为2:1.
因为SO2先和Na2S反应,所以温度相同时,同物质的量浓度的Na2S溶液和Na2CO3溶液,Na2S溶液的pH更大;
故答案为:2:1;前者;
(4)①为保证不变质,配制硫代硫酸钠溶液须用新煮沸并冷却的蒸馏水,其理由是:防止Na2S2O3被空气中O2氧化;
故答案为:防止Na2S2O3被空气中O2氧化;
②达到滴定终点时,当滴加最后一滴硫代硫酸钠溶液,溶液蓝色褪去且半分钟内不再变化,
2次消耗的I2溶液的体积平均值为20.00mL,
2S2O32-+I3-→S4O62-+3I-
2 1
n 0.0500mol/L×0.020L
n=0.002mol
250ml溶液中含有Cr2O72-物质的量为0.002mol×
=0.01mol;
Na2S2O3?5H2O(式量248)的质量分数是=
×100%=99.20%
故答案为:当滴加最后一滴硫代硫酸钠溶液,溶液蓝色褪去且半分钟内不再变化;99.20%.
故答案为:d;打开分液漏斗活塞加水,如水无法滴入说明气密性良好;
(2)①浅黄色沉淀先逐渐增多,其反应原理为SO2+Na2S+H2O=H2S+Na2SO3,2H2S+SO2=3S↓+2H2O,即反应的化学方程式为:3SO2+2Na2S=3S↓+2Na2SO3;
故答案为:3SO2+2Na2S=3S↓+2Na2SO3;
②浅黄色沉淀保持一段时间不变,有无色无嗅的气体产生,则反应的化学方程式为,无色无味的气体为CO2气体,其化学方程式为SO2+Na2CO3=Na2SO3+CO2;
故答案为:SO2+Na2CO3=Na2SO3+CO2;
③浅黄色沉淀逐渐减少,这时有Na2S2O3生成黄色沉淀,减少的原理为:Na2SO3+S=Na2S2O3,故答案为:Na2SO3+S=Na2S2O3;
④根据题意Na2S2O3能与中强酸反应,继续通入SO2,浅黄色沉淀又会逐渐增多,所以浅黄色沉淀又增多的原理为:Na2S2O3+SO2+H2O=S↓+2NaHSO3;
故答案为:Na2S2O3+SO2+H2O=S↓+2NaHSO3;
(3)3SO2+2Na2S=3S↓+2Na2SO3①
SO2+Na2CO3=Na2SO3+CO2②
Na2SO3+S=Na2S2O3③
①+②+③×3得
4SO2+2Na2S+Na2CO3=3Na2S2O3+CO2;
所以Na2S和Na2CO3的物质的量之比为2:1.
因为SO2先和Na2S反应,所以温度相同时,同物质的量浓度的Na2S溶液和Na2CO3溶液,Na2S溶液的pH更大;
故答案为:2:1;前者;
(4)①为保证不变质,配制硫代硫酸钠溶液须用新煮沸并冷却的蒸馏水,其理由是:防止Na2S2O3被空气中O2氧化;
故答案为:防止Na2S2O3被空气中O2氧化;
②达到滴定终点时,当滴加最后一滴硫代硫酸钠溶液,溶液蓝色褪去且半分钟内不再变化,
2次消耗的I2溶液的体积平均值为20.00mL,
2S2O32-+I3-→S4O62-+3I-
2 1
n 0.0500mol/L×0.020L
n=0.002mol
250ml溶液中含有Cr2O72-物质的量为0.002mol×
| 50 |
| 10 |
Na2S2O3?5H2O(式量248)的质量分数是=
| 0.01mol×248g/mol |
| 2.500g |
故答案为:当滴加最后一滴硫代硫酸钠溶液,溶液蓝色褪去且半分钟内不再变化;99.20%.
点评:本题考查了物质制备实验方法,实验流程的分析判断,主要是物质性质,化学方程式书写,定量计算的应用,掌握基础是关键,题目难度中等.

练习册系列答案
 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案
相关题目
 下列由相关图象作出的描述正确的是( )
下列由相关图象作出的描述正确的是( )| A、实验Ⅰ:滴加稀盐酸,NaHCO3先反应立即产生大量气泡 |
| B、实验Ⅱ:振荡后静置分层,上层无色溶液从上口倒出 |
| C、实验Ⅲ:从饱和硫酸钠溶液中提取硫酸钠晶体 |
| D、装置Ⅳ:酸性KMnO4溶液中出现气泡,溶液颜色逐渐褪去 |
某溶液中可能含有Na+、Fe2+、Br-、CO32-、I-、SO32-六种离子中的几种.
(1)取该溶液少量滴加足量氯水后,有气泡产生、溶液呈橙黄色;
(2)向呈橙黄色的溶液中加入氯化钡溶液无沉淀生成;
(3)橙黄色溶液不能使淀粉溶液变蓝.根据上述事实推断,在原溶液中肯定都存在的离子组是( )
(1)取该溶液少量滴加足量氯水后,有气泡产生、溶液呈橙黄色;
(2)向呈橙黄色的溶液中加入氯化钡溶液无沉淀生成;
(3)橙黄色溶液不能使淀粉溶液变蓝.根据上述事实推断,在原溶液中肯定都存在的离子组是( )
| A、Na+、Br-、CO32- |
| B、Na+、I-、SO32- |
| C、Fe2+、I-、SO32- |
| D、Fe2+、Br-、CO32- |
在一定温度下可逆反应H2(g)+I2(g)?2HI(g) 达到平衡的标志是( )
| A、有1mol H-H键断裂,同时有1 mol I-I键形成 |
| B、容器内压强不再随时间而变化 |
| C、υ正(H2)=υ逆(HI) |
| D、H2、I2、HI的浓度之比为1:1:2 |
一定质量的铁、氧化铁、氧化铜的混合物粉末放入100mL4.40mol/L盐酸中,充分反应后产生896mL H2(标准状况),残留固体1.28g.过滤,滤液中无Cu2+,将滤液加水稀释到200mL,测得其中c(H+)为0.40mol/L.则原混合物中单质铁的质量是( )
| A、2.4g |
| B、10.08g |
| C、3.36g |
| D、5.60g |
下列说法不正确的是( )
| A、将盐酸、KSCN溶液和Fe(NO3)2溶液三种溶液混合,混合溶液显红色 |
| B、SO2通入Fe2(SO4)3溶液中,无明显现象 |
| C、SO2通入已酸化的Ba(NO3)2溶液中,出现白色沉淀 |
| D、在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液后红色褪去 |

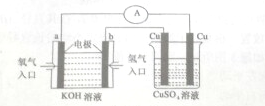 氢氧燃料电池能量转化率高,具有广阔的发展前景,先用氢氧燃料电池进行如图所示实验:
氢氧燃料电池能量转化率高,具有广阔的发展前景,先用氢氧燃料电池进行如图所示实验:
