题目内容
常温下,现有NaCl和CuSO4的混合溶液,用Pt电极电解,当电路中通过0.4mol电子的电量时,阴阳两极都产生0.15mol的气体,若电解后溶液体积为10L,则电解后溶液的pH为( )
| A、2 | B、5 | C、9 | D、12 |
考点:pH的简单计算,电解原理
专题:
分析:当电路中通过0.4mol电子的电量时,阴阳两极都产生0.15mol的气体,阴极产生的气体为H2,阳极产生的气体为Cl2和O2,生成0.15molH2转移电子为0.15mol×2=0.3mol,所以阴极析出Cu的物质的量=
=0.05mol.令阳极气体中Cl2、O2的物质的量分别为xmol、ymol,根据转移的电子数和产生气体的物质的量列方程计算,据此判断整个电解过程中各阶段发生的反应,据此计算.
| 0.4mol-0.3mol |
| 2 |
解答:
解:根据题意可知,当电路中通过0.4mol电子的电量时,阴阳两极都产生0.15mol的气体,阴极产生的气体为H2,阳极产生的气体为Cl2和O2,
生成0.15molH2转移电子为0.15mol×2=0.3mol,所以阴极析出Cu的物质的量=
=0.05mol.令阳极气体中Cl2、O2的物质的量分别为xmol、ymol,根据转移的电子数和产生气体的物质的量,则:
,解得x=0.01,y=0.05,
所以整个电解过程分为三段:
第一阶段,氯离子、铜离子放电,阳极产生0.05molCl2,阴极产生0.05molCu,此时溶液的pH变化不大;
第二阶段,氯离子、水放电,阳极产生0.05molCl2,阴极产生0.05molH2,此时溶液中产生0.05molOH-,溶液的pH增大;
第三阶段,电解水生成氢气与氧气,阳极产生0.05molO2,阴极产生0.1molH2,此时溶液中产生0.05molOH-,所以溶液中c(OH-)=
=0.01mol/L,故溶液pH=12,
故选D.
生成0.15molH2转移电子为0.15mol×2=0.3mol,所以阴极析出Cu的物质的量=
| 0.4mol-0.3mol |
| 2 |
|
所以整个电解过程分为三段:
第一阶段,氯离子、铜离子放电,阳极产生0.05molCl2,阴极产生0.05molCu,此时溶液的pH变化不大;
第二阶段,氯离子、水放电,阳极产生0.05molCl2,阴极产生0.05molH2,此时溶液中产生0.05molOH-,溶液的pH增大;
第三阶段,电解水生成氢气与氧气,阳极产生0.05molO2,阴极产生0.1molH2,此时溶液中产生0.05molOH-,所以溶液中c(OH-)=
| 0.1mol |
| 10L |
故选D.
点评:本题考查电解的计算,难度较大,主要考查学生的分析能力,根据阴阳两极的气体物质的量判断气体的成分是解题的关键.

练习册系列答案
相关题目
 如图是一水溶液在pH从0到14的范围内,H2CO3、HCO3-、CO32-三种成分平衡时的组成分数,下列叙述正确的是( )
如图是一水溶液在pH从0到14的范围内,H2CO3、HCO3-、CO32-三种成分平衡时的组成分数,下列叙述正确的是( )| A、此图是1.0 mol/L碳酸钠溶液滴定1.0 mol/L HCl溶液的滴定曲线 |
| B、在pH为6.37及10.25时,溶液中c(H2CO3)=c(HCO3-)=c(CO32-) |
| C、人体血液的pH约为7.4,则CO2在血液中多以HCO3-的形式存在 |
| D、若用CO2和NaOH反应制取Na2CO3,溶液的pH必须控制在10以上 |
氮氧化物与悬浮在大气中的海盐粒子相互反应:4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g)
在恒温条件下,向2L恒容密闭容器中加入0.4molNO2和0.2molNaCl,10min反应达到平衡时n(NaNO3)=0.1mol.下列叙述中正确的是( )
在恒温条件下,向2L恒容密闭容器中加入0.4molNO2和0.2molNaCl,10min反应达到平衡时n(NaNO3)=0.1mol.下列叙述中正确的是( )
| A、10min内NO浓度变化表示的速率v(NO)=0.01 mol?L-1?min-1 |
| B、若保持其他条件不变,在恒压下进行该反应,则平衡时NO2的转化率大于50% |
| C、若升高温度,平衡逆向移动,则该反应的△H>0 |
| D、若起始时向容器中充入NO2(g)0.2mol、NO(g)0.1mol和Cl2(g)0.1mol(固体物质足量),则反应将向逆反应方向进行 |
下列装置图与对应的叙述相符的是( )
A、 发生的反应为Cu+2Fe3+=Cu2++2Fe2+,X极是负极,Y极的材料也可以是铜 |
B、 负极反应是Fe-2e-=Fe2+ |
C、 铁腐蚀的速度由大到小的顺序是:只闭合K1>只闭合K3>都断开>只闭合K2 |
D、 可以实现在铁制品上镀上一层铜 |
下列说法与盐类水解无关的是( )
| A、实验室配制FeCl3溶液时用盐酸溶解FeCl3固体 |
| B、向沸水中滴加饱和FeCl3溶液加热至红褐色制得Fe(OH)3胶体 |
| C、短期保存FeCl2溶液时向其中加入少量铁粉 |
| D、保存Na2CO3溶液的试剂瓶用橡胶塞而不能用玻璃塞 |
下列说法中正确的是( )
| A、在化学反应过程中,发生物质变化的同时不一定发生能量变化 |
| B、化学反应中的能量变化都表现为热量变化 |
| C、△H的大小与热化学方程式的计量数无关 |
| D、生成物的总焓大于反应物的总焓时,反应吸热,△H>0 |
下列应用或事实与胶体的性质没有关系的是( )
| A、用明矾净化饮用水 |
| B、可以利用丁达尔效应鉴别胶体和溶液 |
| C、在FeCl3溶液中滴加NaOH溶液出现红褐色沉淀 |
| D、清晨的阳光穿过茂密的林木枝叶所产生的美丽的光线 |
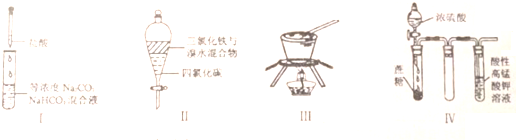 下列由相关图象作出的描述正确的是( )
下列由相关图象作出的描述正确的是( )| A、实验Ⅰ:滴加稀盐酸,NaHCO3先反应立即产生大量气泡 |
| B、实验Ⅱ:振荡后静置分层,上层无色溶液从上口倒出 |
| C、实验Ⅲ:从饱和硫酸钠溶液中提取硫酸钠晶体 |
| D、装置Ⅳ:酸性KMnO4溶液中出现气泡,溶液颜色逐渐褪去 |