题目内容
亚氯酸钠(NaClO2)是一种高效氧化剂、漂白剂.已知:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2?3H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl.利用如图所示装置制备亚氯酸钠.
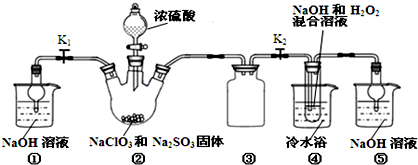
(1)装置②中产生ClO2的化学方程式为 .装置③的作用是 .
(2)从装置④反应后的溶液获得NaClO2晶体的操作步骤为:
①减压,55℃蒸发结晶;
② ;
③ ;
④低于60℃干燥,得到成品.
(3)准确称取所得亚氯酸钠样品10g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(ClO2-+4I-+4H+→2H2O+2I2+Cl-).将所得混合液配成250mL待测溶液.配制待测液需用到的定量玻璃仪器是 .
(4)取25.00mL待测液,用2.0mol/L Na2S2O3标准液滴定(I2+2S2O32-→2I-+S4O62-),以淀粉溶液做指示剂,达到滴定终点时的现象为 .重复滴定2次,测得Na2S2O3溶液平均值为20.00mL.该样品中NaClO2的质量分数为 .
(5)通过分析说明装置①在本实验中的作用 .

(1)装置②中产生ClO2的化学方程式为
(2)从装置④反应后的溶液获得NaClO2晶体的操作步骤为:
①减压,55℃蒸发结晶;
②
③
④低于60℃干燥,得到成品.
(3)准确称取所得亚氯酸钠样品10g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(ClO2-+4I-+4H+→2H2O+2I2+Cl-).将所得混合液配成250mL待测溶液.配制待测液需用到的定量玻璃仪器是
(4)取25.00mL待测液,用2.0mol/L Na2S2O3标准液滴定(I2+2S2O32-→2I-+S4O62-),以淀粉溶液做指示剂,达到滴定终点时的现象为
(5)通过分析说明装置①在本实验中的作用
考点:制备实验方案的设计
专题:实验设计题
分析:(1)根据反应物NaClO3、Na2SO3、H2SO4,生成物为ClO2和2Na2SO4,配平方程式为2NaClO3+Na2SO3+H2SO4=2ClO2+2Na2SO4+H2O;装置③为安全瓶,防止装置②中气体温度降低而产生倒吸;
(2)因为NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2?3H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl,若要得到NaClO2晶体,需在38-60℃得到晶体,故操作为趁热过滤;用38-60℃的温水洗涤;
(3)容量瓶要指明规格;
(4)有碘单质参和生成的反应,一般采用淀粉溶液做指示剂,该反应是Na2S2O3标准液滴定碘,终点溶液由蓝色变为无色且半分钟内不变色;
计算时一般找出关系式,由此进行计算,关系式为ClO2---2I2--4S2O32-,n(ClO2-)=
n(S2O32-)=
×20×10-3×2=0.01mol,m(NaClO2)=0.01×90.5=9.05g,计算得到样品中NaClO2的质量分数;
(5)本实验产生污染性气体,直接排放会污染环境,故需要尾气处理,装置①就是用碱吸收反应产生的ClO2等尾气.
(2)因为NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2?3H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl,若要得到NaClO2晶体,需在38-60℃得到晶体,故操作为趁热过滤;用38-60℃的温水洗涤;
(3)容量瓶要指明规格;
(4)有碘单质参和生成的反应,一般采用淀粉溶液做指示剂,该反应是Na2S2O3标准液滴定碘,终点溶液由蓝色变为无色且半分钟内不变色;
计算时一般找出关系式,由此进行计算,关系式为ClO2---2I2--4S2O32-,n(ClO2-)=
| 1 |
| 4 |
| 1 |
| 4 |
(5)本实验产生污染性气体,直接排放会污染环境,故需要尾气处理,装置①就是用碱吸收反应产生的ClO2等尾气.
解答:
解:(1)根据反应物NaClO3、Na2SO3、H2SO4,生成物为ClO2和2Na2SO4,配平方程式为:2NaClO3+Na2SO3+H2SO4=2ClO2+2Na2SO4+H2O;装置③为安全瓶,防止装置②中气体温度降低而产生倒吸,
故答案为:2NaClO3+Na2SO3+H2SO4=2ClO2+2Na2SO4+H2O;防止倒吸;
(2)因为NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2?3H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl,若要得到NaClO2晶体,需在38-60℃得到晶体,故操作为趁热过滤;用38-60℃的温水洗涤,
故答案为:趁热过滤;用38-60℃的温水洗涤;
(3)将所得混合液配成250mL待测溶液.配制待测液需用到的定量玻璃仪器是250mL容量瓶,容量瓶要指明规格,则选择250mL容量瓶,
故答案为:250mL容量瓶;
(4)有碘单质参和生成的反应,一般采用淀粉溶液做指示剂,该反应是Na2S2O3标准液滴定碘,滴入最后一滴Na2S2O3标准液,终点溶液由蓝色变为无色且半分钟内不变色;
计算时一般找出关系式,由此进行计算,关系式为ClO2---2I2--4S2O32-
n(ClO2-)=
n(S2O32-)=
×20×10-3×2=0.01mol
m(NaClO2)=0.01×90.5=9.05g,
计算得到样品中NaClO2的质量分数=
×100%=90.5%;
故答案为:滴入最后一滴Na2S2O3标准液由蓝色变为无色且半分钟内不变色;90.5%;
(5)本实验产生污染性气体,直接排放会污染环境,故需要尾气处理,装置①就是用碱吸收反应产生的ClO2等尾气,当关闭K2时,打开K1,可以吸收反应产生的气体,故答案为:当关闭K2时,打开K1,可以吸收反应产生的气体.
故答案为:2NaClO3+Na2SO3+H2SO4=2ClO2+2Na2SO4+H2O;防止倒吸;
(2)因为NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2?3H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl,若要得到NaClO2晶体,需在38-60℃得到晶体,故操作为趁热过滤;用38-60℃的温水洗涤,
故答案为:趁热过滤;用38-60℃的温水洗涤;
(3)将所得混合液配成250mL待测溶液.配制待测液需用到的定量玻璃仪器是250mL容量瓶,容量瓶要指明规格,则选择250mL容量瓶,
故答案为:250mL容量瓶;
(4)有碘单质参和生成的反应,一般采用淀粉溶液做指示剂,该反应是Na2S2O3标准液滴定碘,滴入最后一滴Na2S2O3标准液,终点溶液由蓝色变为无色且半分钟内不变色;
计算时一般找出关系式,由此进行计算,关系式为ClO2---2I2--4S2O32-
n(ClO2-)=
| 1 |
| 4 |
| 1 |
| 4 |
m(NaClO2)=0.01×90.5=9.05g,
计算得到样品中NaClO2的质量分数=
| 9.05g |
| 10g |
故答案为:滴入最后一滴Na2S2O3标准液由蓝色变为无色且半分钟内不变色;90.5%;
(5)本实验产生污染性气体,直接排放会污染环境,故需要尾气处理,装置①就是用碱吸收反应产生的ClO2等尾气,当关闭K2时,打开K1,可以吸收反应产生的气体,故答案为:当关闭K2时,打开K1,可以吸收反应产生的气体.
点评:本题考查了物质制备方法和实验设计,步骤理解应用,掌握物质性质和实验基本操作是解题关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列说法中正确的是( )
| A、在化学反应过程中,发生物质变化的同时不一定发生能量变化 |
| B、化学反应中的能量变化都表现为热量变化 |
| C、△H的大小与热化学方程式的计量数无关 |
| D、生成物的总焓大于反应物的总焓时,反应吸热,△H>0 |
下列叙述正确的是( )
| A、只含一种元素的物质,可能为混合物 | ||
| B、非金属元素都是主族元素,最外层电子数都大于或等于3 | ||
C、
| ||
| D、工业由N2制备氨气以及由NH3氧化制备硝酸的过程都属于氮的固定 |
下列叙述正确的是( )
| A、与28 g CO具有相同分子数的CO2的质量一定是44 g |
| B、与V L CO具有相同分子数的CO2,其体积一定是V L |
| C、含有相等氧原子数的CO与CO2,其质量之比为28:11 |
| D、含有相等碳原子数的CO与CO2,其密度之比为21:22 |
 下列由相关图象作出的描述正确的是( )
下列由相关图象作出的描述正确的是( )| A、实验Ⅰ:滴加稀盐酸,NaHCO3先反应立即产生大量气泡 |
| B、实验Ⅱ:振荡后静置分层,上层无色溶液从上口倒出 |
| C、实验Ⅲ:从饱和硫酸钠溶液中提取硫酸钠晶体 |
| D、装置Ⅳ:酸性KMnO4溶液中出现气泡,溶液颜色逐渐褪去 |

 二茂铁(结构如图1)是一个典型的金属有机化合物,实验室常用氯化亚铁和环戊二烯在碱性条件下反应得到.反应原理为:FeCl2+2C5H6+2KOH→Fe(C5H5)2+2KCl+2H2O
二茂铁(结构如图1)是一个典型的金属有机化合物,实验室常用氯化亚铁和环戊二烯在碱性条件下反应得到.反应原理为:FeCl2+2C5H6+2KOH→Fe(C5H5)2+2KCl+2H2O
 氢氧燃料电池能量转化率高,具有广阔的发展前景,先用氢氧燃料电池进行如图所示实验:
氢氧燃料电池能量转化率高,具有广阔的发展前景,先用氢氧燃料电池进行如图所示实验: