题目内容
Na2O2的电子式为 . (判断对确)
. (判断对确)

考点:电子式
专题:
分析:过氧化钠是离子化合物,其电子式由阴、阳离子的电子式组合而成,相同的离子不能合并.
解答:
解:Na2O2是钠离子和过氧根离子构成的离子化合物,钠离子失电子形成阳离子,氧原子得到电子形成过氧根阴离子,电子式为 ,故答案为:×.
,故答案为:×.
 ,故答案为:×.
,故答案为:×.
点评:本题考查了电子式的书写方法,一般共价化合物中各元素的化合价的绝对值就是该元素原子形成的共用电子对数;离子化合物中原子团的电子式不仅要标出最外层电子数,而且要用“[]”括起来,在右上角标明离子所带的电荷,并要表示出两原子之间的共用电子对情况.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目
氮氧化物与悬浮在大气中的海盐粒子相互反应:4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g)
在恒温条件下,向2L恒容密闭容器中加入0.4molNO2和0.2molNaCl,10min反应达到平衡时n(NaNO3)=0.1mol.下列叙述中正确的是( )
在恒温条件下,向2L恒容密闭容器中加入0.4molNO2和0.2molNaCl,10min反应达到平衡时n(NaNO3)=0.1mol.下列叙述中正确的是( )
| A、10min内NO浓度变化表示的速率v(NO)=0.01 mol?L-1?min-1 |
| B、若保持其他条件不变,在恒压下进行该反应,则平衡时NO2的转化率大于50% |
| C、若升高温度,平衡逆向移动,则该反应的△H>0 |
| D、若起始时向容器中充入NO2(g)0.2mol、NO(g)0.1mol和Cl2(g)0.1mol(固体物质足量),则反应将向逆反应方向进行 |
下列应用或事实与胶体的性质没有关系的是( )
| A、用明矾净化饮用水 |
| B、可以利用丁达尔效应鉴别胶体和溶液 |
| C、在FeCl3溶液中滴加NaOH溶液出现红褐色沉淀 |
| D、清晨的阳光穿过茂密的林木枝叶所产生的美丽的光线 |
下列叙述正确的是( )
| A、只含一种元素的物质,可能为混合物 | ||
| B、非金属元素都是主族元素,最外层电子数都大于或等于3 | ||
C、
| ||
| D、工业由N2制备氨气以及由NH3氧化制备硝酸的过程都属于氮的固定 |
把x mL CO2通过足量的Na2O2后再与y mL NO混合,x与y之和为30.设充分反应后气体的体积缩小为15mL,(不考虑NO2转化为N2O4 ),则x:y可能为( )
①1?:1 ②2?:1 ③5?:4 ④7?:5.
①1?:1 ②2?:1 ③5?:4 ④7?:5.
| A、只有① | B、只有② |
| C、只有③④ | D、①②③④ |
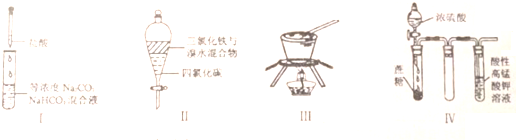 下列由相关图象作出的描述正确的是( )
下列由相关图象作出的描述正确的是( )| A、实验Ⅰ:滴加稀盐酸,NaHCO3先反应立即产生大量气泡 |
| B、实验Ⅱ:振荡后静置分层,上层无色溶液从上口倒出 |
| C、实验Ⅲ:从饱和硫酸钠溶液中提取硫酸钠晶体 |
| D、装置Ⅳ:酸性KMnO4溶液中出现气泡,溶液颜色逐渐褪去 |