题目内容
0.5mol/l的H2SO4的pH等于 .
考点:pH的简单计算
专题:电离平衡与溶液的pH专题
分析:硫酸为二元强酸,根据溶液中电离出的氢离子浓度结合PH=-lgC(H+)公式即可解答.
解答:
解:硫酸为强电解质,完全电离,电离方程式:H2SO4=2H++SO42-,0.5mol/l的H2SO4的C(H+)=0.5mol/l×2=1mol/L,PH=-lgC(H+)=0,
故答案为:0;
故答案为:0;
点评:本题考查了PH的简单计算,注意硫酸为二元强酸以及PH=-lgC(H+)公式应用是解题关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
把x mL CO2通过足量的Na2O2后再与y mL NO混合,x与y之和为30.设充分反应后气体的体积缩小为15mL,(不考虑NO2转化为N2O4 ),则x:y可能为( )
①1?:1 ②2?:1 ③5?:4 ④7?:5.
①1?:1 ②2?:1 ③5?:4 ④7?:5.
| A、只有① | B、只有② |
| C、只有③④ | D、①②③④ |
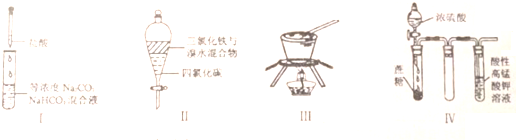 下列由相关图象作出的描述正确的是( )
下列由相关图象作出的描述正确的是( )| A、实验Ⅰ:滴加稀盐酸,NaHCO3先反应立即产生大量气泡 |
| B、实验Ⅱ:振荡后静置分层,上层无色溶液从上口倒出 |
| C、实验Ⅲ:从饱和硫酸钠溶液中提取硫酸钠晶体 |
| D、装置Ⅳ:酸性KMnO4溶液中出现气泡,溶液颜色逐渐褪去 |
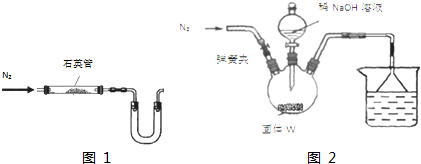
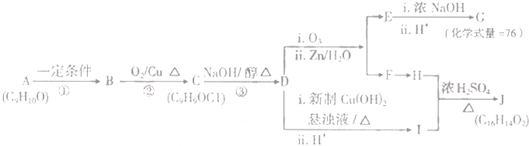
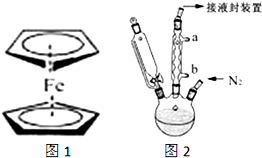 二茂铁(结构如图1)是一个典型的金属有机化合物,实验室常用氯化亚铁和环戊二烯在碱性条件下反应得到.反应原理为:FeCl2+2C5H6+2KOH→Fe(C5H5)2+2KCl+2H2O
二茂铁(结构如图1)是一个典型的金属有机化合物,实验室常用氯化亚铁和环戊二烯在碱性条件下反应得到.反应原理为:FeCl2+2C5H6+2KOH→Fe(C5H5)2+2KCl+2H2O