题目内容
4.为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验.请回答相关问题:
(1)定性分析
如图甲:可通过观察反应产生气泡快慢,定性比较得出结论对实验甲,有同学提出“FeCl3”改为Fe2(SO4)3或“CuSO4”改为CuCl2更为合理,其理由是消除阴离子不同对实验的干扰.
(2)定量分析
如图乙:实验时均以生成40mL 气体为准,其他可能影响实验的因素均已忽略.检查该装置气密性的方法是关闭分液漏斗活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位,实验中需要测量的数据是产生40mL气体所需的时间.
(3)加入0.01molMnO2粉末于50mLH2O2溶液中,在标准状况下放出气体的体积和时间的关系如图丙所示.
①写出H2O2在二氧化锰作用下发生反应的化学方程式2H2O2 $\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
②放出$\frac{1}{3}$气体所需时间为1min.
③A、B、C、D各点反应速率快慢的顺序为D>C>B>A.
④解释反应速率变化的原因随着反应的进行,浓度减小,反应速率减慢.
⑤计算机H2O2的初始物质的量浓度0.11mol•L-1.
分析 (1)根据反应生成气体的快慢分析出Fe3+和Cu2+对H2O2分解的催化效果;根据H2O2分解的催化作用有可能是氯离子或硫酸根离子起的作用,所以在比较阳离子的催化效果时,阴离子要完全相同;
(2)根据乙图装置有注射器,从而选择气密性的检查方法;该反应是通过反应速率分析的,所以根据v=$\frac{△C}{△t}$来判断还需要测量的数据;
(3)①在二氧化锰催化作用下,双氧水分解生成氧气和水;
②根据图象确定放出$\frac{1}{3}$气体所需时间;
③根据v=$\frac{△V}{△t}$比较反应速率快慢;
④物质的浓度与反应速率成正比;
⑤根据氧气的量计算双氧水的物质的量,再根据C=$\frac{n}{V}$计算物质的量浓度.
解答 解:(1)该反应产生气体,而且反应放热,可根据反应产生气泡快慢或反应完成的先后或试管壁的冷热程度来判断;H2O2分解的催化作用有可能是氯离子或硫酸根离子起的作用,所以在比较阳离子的催化效果时,阴离子要完全相同,这样可以消除阴离子不同对实验的干扰,所以将“FeCl3”改为Fe2(SO4)3或“CuSO4”改为CuCl2更为合理,
故答案为:反应产生气泡快慢;消除阴离子不同对实验的干扰;
(2)结合乙图装置,该气密性的检查方法为:关闭分液漏斗活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位;反应是通过反应速率分析的,根据v=$\frac{△C}{△t}$,所以实验中需要测量的数据是时间(或收集一定体积的气体所需要的时间),
故答案为:关闭分液漏斗活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位;产生40mL气体所需的时间;
(3)①双氧水在二氧化锰作用下生成水和氧气,所以反应方程式为2H2O2 $\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,故答案为:2H2O2 $\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
②根据图象知,放出$\frac{1}{3}$气体的体积为20mL,所需时间为1min,故答案为:1;
③根据图象结合v=$\frac{△V}{△t}$知,A、B、C、D各点反应速率快慢的顺序为D>C>B>A,故答案为:D;C;B;A;
④反应速率与反应物浓度成正比,随着反应的进行,反应物浓度逐渐降低,反应速率逐渐减小,
故答案为:随着反应的进行,浓度减小,反应速率减慢;
⑤设双氧水的物质的量为x,
2H2O2 $\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑
2mol 22.4L
x 0.06L
x=$\frac{2mol×0.06L}{22.4L}$=0.0054mol,
所以其物质的量浓度=$\frac{0.0054mol}{0.05L}$=0.11 mol•L-1,
故答案为:0.11 mol•L-1.
点评 本题考查实验方案的设计,注意在探究催化剂对化学反应速率的影响时控制变量消除阴离子的干扰的重要性;根据v=$\frac{△V}{△t}$来设计实验,通过得到气体的体积和时间的关系确定影响反应速率的因素,难度中等.

| X | Y | ||
| Z | W | ||
| T |
| A. | W、Z、T元素的原子半径及它们的最高价氧化的水化物的酸性均依次递增 | |
| B. | X、Y在自然界中都存在多种同素异形体,其氢化物的沸点一定是后者高 | |
| C. | ZY2、WY2可以形成同种类型的晶体,它们都有杀菌消毒的作用 | |
| D. | 根据元素周期律,可以推测Y、Z、T元素的单质与H2化合时的△H逐渐减少 |
①消去反应②取代反应③加成反应④水解反应.
| A. | ①② | B. | ①②③ | C. | ②③ | D. | ①②③④ |
2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑
现用氧化还原滴定法测定草酸晶体的结晶水分子数X,步骤如下:
①用分析天平称取草酸晶体1.440g,将其配制成100.00mL待测草酸溶液
②用移液管移取25.00mL待测草酸溶液于锥形瓶中,并加入适量硫酸酸化
③用浓度为0.1000mol•L-1的KMnO4标准溶液进行滴定,三次结果如下:
| 第一次滴定 | 第二次滴定 | 第三次滴定 | |
| 待测溶液体积(mL) | 25.00 | 25.00 | 25.00 |
| 标准溶液体积(mL) | 9.99 | 10.01 | 10.00 |
(1)滴定时,KMnO4标准溶液应该装在酸式(填酸式或碱式)滴定管中.
(2)在整个实验过程中,不需要的仪器或用品是④⑥(填序号).
①100mL容量瓶 ②烧杯 ③滴定管夹 ④漏斗 ⑤玻璃棒 ⑥托盘天平
(3)到达滴定终点的标志是加入最后一滴KMnO4溶液,溶液变为浅紫红色,且30s内不褪色.
(4)根据上述数据计算X=3.
(5)若滴定开始时仰视滴定管刻度,滴定结束时俯视滴定管刻度,则X值偏高(填:偏高、偏低、无影响).
(6)若KMnO4标准溶液浓度偏低,则X值偏低(填:偏高、偏低、无影响).
| A. | 1 mol羟基与17 g NH3所含电子数都为NA | |
| B. | 电解精炼铜的过程中,每转移NA个电子时,阳极溶解铜的质量为32 g | |
| C. | 常温常压下,28 g C2H4、C3H6的混合气体中含有碳原子的数目为2NA | |
| D. | 适量铜粉溶解于1 L 0.5 mol•L-1稀硝酸中,当生成2.24 L NO时,溶液中氮原子数为0.4 NA |
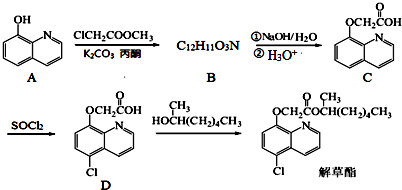
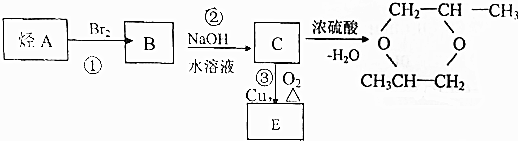
 ;由C→D的反应类型是取代反应.
;由C→D的反应类型是取代反应.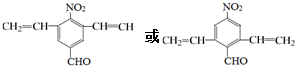 .
.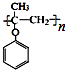 )的合成路线流程(无机试剂可任选).合成路线流程图示例如下:
)的合成路线流程(无机试剂可任选).合成路线流程图示例如下: