题目内容
18.以下是对某水溶液进行SO42-离子检验的方法和结论,其中正确的是( )| A. | 加入BaCl2溶液,产生了白色沉淀.则溶液中一定含有SO42- | |
| B. | 加入BaCl2溶液产生了白色沉淀,再加盐酸,沉淀不消失,则溶液中一定含有SO42- | |
| C. | 加入盐酸酸化的氯化钡溶液,产生白色沉淀,则溶液中一定有SO42- | |
| D. | 加入盐酸,溶液无明显现象,再加BaCl2溶液,产生了白色沉淀.则溶液中一定含有SO42- |
分析 对某水溶液进行SO42-离子检验,应先加盐酸无现象,排除干扰离子,再加氯化钡,生成白色沉淀,可证明含SO42-,以此来解答.
解答 解:A.白色沉淀可能为AgCl,溶液中不一定含有SO42-,故A不选;
B.白色沉淀可能为AgCl,加盐酸不溶解,溶液中不一定含有SO42-,故B不选;
C.加入盐酸酸化的氯化钡溶液,产生白色沉淀,白色沉淀可能为AgCl,则溶液中不一定有SO42-,故C不选;
D.加入盐酸,溶液无明显现象,排除干扰离子,再加BaCl2溶液,产生了白色沉淀,白色沉淀为硫酸钡,则溶液中一定含有SO42-,故D选;
故选D.
点评 本题考查常见离子的检验,为高频考点,把握离子检验的试剂、现象和结论为解答的关键,侧重分析与实验能力的考查,注意排除干扰离子,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
3.能正确表示下列反应的离子方程式是( )
| A. | 将铜屑加入Fe3+溶液中:2Fe3++Cu═2Fe2++Cu2+ | |
| B. | 将磁性氧化铁溶于盐酸:Fe3O4+8H+═3Fe3++4H2O | |
| C. | 氯化亚铁溶液中通入氯气:Fe2++Cl2═Fe3++2Cl- | |
| D. | 将铁粉加入稀硫酸中:2Fe+6H+═2Fe3++3H2↑ |
10.如图,各烧杯中盛有海水,铁在其中被腐蚀时由快到慢的顺序是( )
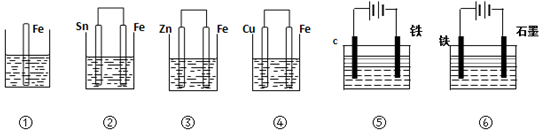

| A. | ④>②>①>③>⑤>⑥ | B. | ⑥>④>②>①>③>⑤ | C. | ④>②>⑤>③>⑥>① | D. | ⑥>③>②>④>①>⑤ |
7.下列有关离子(或物质)的检验及结论,不正确的是( )
| A. | 用丁达尔效应可鉴别FeCl3溶液和Fe(OH)3胶体 | |
| B. | 在某未知成分的溶液中滴入足量盐酸,如观察到无色无味的气体产生,且能使澄清石灰水变浑浊,即证明溶液中必定有CO32- | |
| C. | 向某无色溶液中加入BaCl2溶液,有白色沉淀出现,再加入稀盐酸,沉淀不消失,无法证明溶液一定含有SO42- | |
| D. | 氨气能使湿润的红色石蕊试纸变蓝,说明氨气的水溶液呈碱性 |
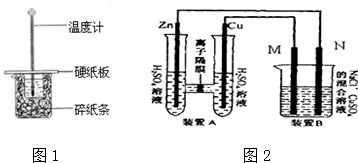
 50mL 0.50mol/L盐酸跟50mL 0.55mol/L NaOH溶液在如图所示的装置 中进行中和反应,通过测定反应过程中所放出的热量可计算反应热.
50mL 0.50mol/L盐酸跟50mL 0.55mol/L NaOH溶液在如图所示的装置 中进行中和反应,通过测定反应过程中所放出的热量可计算反应热.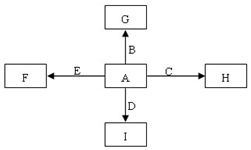 图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物.已知:①反应C+G$\stackrel{高温}{→}$B+H能放出大量的热,该反应曾应用于铁轨的焊接;
图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物.已知:①反应C+G$\stackrel{高温}{→}$B+H能放出大量的热,该反应曾应用于铁轨的焊接; ,它的空间构型是直线型;
,它的空间构型是直线型;