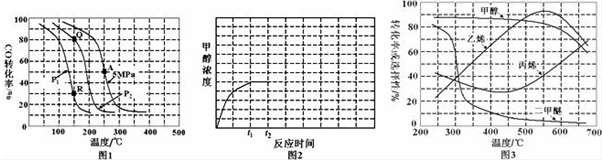
题目内容
8.我国化工专家侯德榜大胆改革国外氨碱法生产工艺发明了联合制碱法,联合制碱法所得最终的化工产品是Na2CO3、NH4Cl.分析 我国化工专家侯德榜发明了“联合制碱法”,其生产过程中发生的反应主要是:
①NH3+CO2+H2O═NH4HCO3
②NH4HCO3+NaCl═NaHCO3↓+NH4Cl
③2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑
解答 解:由侯氏制碱原理:NH3+CO2+H2O+NaCl═NaHCO3↓+NH4Cl和2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,最终的化工产品是Na2CO3、NH4Cl,
故答案为:Na2CO3、NH4Cl.
点评 本题主要让学生了解化学的发展历史,关注化学学科成就,有利于激发学习化学的兴趣,培养学生的社会责任感.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
18.实验室用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示: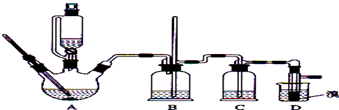
有关数据列表:
回答下列问题:
(1)写出实验室制乙烯的反应方程式CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;
(2)在此实验中,装置A要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是d;(填正确选项前的字母,下面的选择题相同)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(3)在此实验中,装置A中要加些沸石,原因是防止液体暴沸;
(4)在装置C中应加入C,其目的是吸收反应中可能生成的酸性气体:
a.水 b.浓硫酸 c.氢氧化钠溶液 d.CCl4
(5)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”);
(6)若产物中有少量副产物乙醚.应用蒸馏的方法除去;
(7)反应过程中应用冷水冷却装置D,其主要目的是避免溴大量挥发.

有关数据列表:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
(1)写出实验室制乙烯的反应方程式CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;
(2)在此实验中,装置A要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是d;(填正确选项前的字母,下面的选择题相同)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(3)在此实验中,装置A中要加些沸石,原因是防止液体暴沸;
(4)在装置C中应加入C,其目的是吸收反应中可能生成的酸性气体:
a.水 b.浓硫酸 c.氢氧化钠溶液 d.CCl4
(5)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”);
(6)若产物中有少量副产物乙醚.应用蒸馏的方法除去;
(7)反应过程中应用冷水冷却装置D,其主要目的是避免溴大量挥发.
19.已知NO2为红棕色气体,而N2O4为无色气体,某温度下,反应N2O4(g)?2NO2(g);△H>0.在密闭容器中达到平衡,下列说法正确的是( )
| A. | 缩小容器体积,NO2体积分数减小,混合气体颜色变浅 | |
| B. | 保持容器体积不变,加入少许NO2,重新达到平衡时,NO2的体积分数增大 | |
| C. | 保持容器体积不变,加入少许N2O4再达到平衡时,气体颜色变深 | |
| D. | 保持容器体积不变,加入少许NO2,将使正反应速率减小 |
16.对于以下反应:A(s)+3B(g)?2C(g)+D(g),在一定温度、体积固定的密闭容器中进行,下列叙述中能说明上述反应达到平衡状态的是( )
| A. | 混合气体的密度不随时间变化而变化 | |
| B. | 3v正(B)=v逆(D) | |
| C. | D的物质的量分数在混合气体中保持不变 | |
| D. | B、C、D的分子个数之比为3:2:1 |
18.以下是对某水溶液进行SO42-离子检验的方法和结论,其中正确的是( )
| A. | 加入BaCl2溶液,产生了白色沉淀.则溶液中一定含有SO42- | |
| B. | 加入BaCl2溶液产生了白色沉淀,再加盐酸,沉淀不消失,则溶液中一定含有SO42- | |
| C. | 加入盐酸酸化的氯化钡溶液,产生白色沉淀,则溶液中一定有SO42- | |
| D. | 加入盐酸,溶液无明显现象,再加BaCl2溶液,产生了白色沉淀.则溶液中一定含有SO42- |
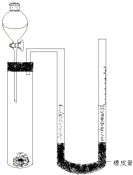 在化学研究领域,经常需要对一些物质进行性质的确定.如利用下列装置(夹持仪器已略去)测出一定质量镁与盐酸反应放出的气体体积,对金属镁的相对原子质量进行测定,实验步骤如下:
在化学研究领域,经常需要对一些物质进行性质的确定.如利用下列装置(夹持仪器已略去)测出一定质量镁与盐酸反应放出的气体体积,对金属镁的相对原子质量进行测定,实验步骤如下: