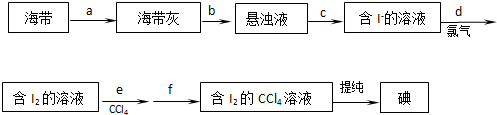
题目内容
5.粗盐中除NaCl外,还含有泥沙、硫酸镁、氯化钙等杂质.某化学兴趣小组的同学提纯粗盐,并利用提纯得到的精盐配制一定物质的量浓度的溶液.请按要求回答下列问题:(一)称取10.0g粗盐进行提纯.
(1)实验步骤:
a.将粗盐溶解在250mL的烧杯中;b.加过量的Ba(OH)2溶液;c.加过量的Na2CO3溶液;
d.过滤; e.加适量的盐酸; f.蒸发滤液.
(2)写出加过量Na2CO3溶液发生的所有离子反应方程式Ca2++CO32-=CaCO3↓、Ba2++CO32-=BaCO3↓.
(二)利用已提纯的精盐配制100mL 1mol/L的NaCl溶液.
(3)正确的操作步骤是:计算、称量、溶解、转移、洗涤、定容、装瓶.
(4)配制NaCl溶液过程中用到主要的仪器除了玻璃棒、烧杯、胶头滴管外还有100mL容量瓶,其中玻璃棒的作用是搅拌、引流.
(5)配制一定物质的量浓度NaCl溶液时,导致浓度偏低的原因可能是B.
A.容量瓶中原有少量的蒸馏水
B.移液时,不慎将液体流到瓶外
C.容量瓶盛过NaCl溶液,使用前未洗涤
D.定容时俯视刻度线.
分析 (一)(1)根据实验步骤可知,加入加过量的Ba(OH)2溶液和过量的Na2CO3溶液能除去粗盐中的Ca2+、SO42-、Mg2+等杂质离子,然后过滤除去生成的沉淀,再加盐酸除去过量的氢氧根和碳酸根离子,据此分析;
(2)加入Na2CO3溶液不但要除去Ca2+,还要除去过量的Ba2+,据此分析离子方程式;
(二)(3)根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、装瓶来分析操作步骤;
(4)根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶来分析需要的仪器和玻璃棒的作用;
(5)根据c=$\frac{n}{V}$并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析;
解答 解:(一)(1)根据实验步骤可知,加入加过量的Ba(OH)2溶液和过量的Na2CO3溶液能除去粗盐中的Ca2+、SO42-、Mg2+等杂质离子,然后过滤除去生成的沉淀,再加盐酸除去过量的氢氧根和碳酸根离子,故步骤e是加入过量的盐酸,故答案为:盐酸;
(2)加入Na2CO3溶液不但要除去Ca2+,还要除去过量的Ba2+,故离子方程式为:Ca2++CO32-=CaCO3↓ Ba2++CO32-=BaCO3↓,故答案为:Ca2++CO32-=CaCO3↓ Ba2++CO32-=BaCO3↓;
(二)(3)根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、装瓶可知所缺少的是定容,故答案为:定容;
(4)根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶可知所需的仪器有玻璃棒、烧杯、胶头滴管、100mL容量瓶,其中玻璃棒的作用有搅拌和引流,故答案为:100mL容量瓶;搅拌、引流;
(5)A.容量瓶中原有少量的蒸馏水对浓度无影响,故A错误;
B.移液时,不慎将液体流到瓶外,则导致溶质的损失,则浓度偏小,故B正确;
C.容量瓶盛过NaCl溶液,使用前未洗涤,则会导致溶质的量偏多,浓度偏高,故C错误;
D.定容时俯视刻度线,则溶液体积偏小,浓度偏高,故D错误.
故选B.
点评 本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,属于基础型题目,难度不大.

 名校课堂系列答案
名校课堂系列答案| A. | 加入BaCl2溶液,产生了白色沉淀.则溶液中一定含有SO42- | |
| B. | 加入BaCl2溶液产生了白色沉淀,再加盐酸,沉淀不消失,则溶液中一定含有SO42- | |
| C. | 加入盐酸酸化的氯化钡溶液,产生白色沉淀,则溶液中一定有SO42- | |
| D. | 加入盐酸,溶液无明显现象,再加BaCl2溶液,产生了白色沉淀.则溶液中一定含有SO42- |
①稀豆浆、硅酸、氯化铁溶液都属于胶体
②HF、HI都属于弱电解质
③Na2O、MgO、Al2O3均属于碱性氧化物
④明矾、冰醋酸、四氧化三铁都不是混合物
⑤葡萄糖、油脂都不属于有机高分子化合物.
| A. | ④⑤ | B. | ②④ | C. | ①② | D. | ③⑤ |
| A. | v (NH3)=0.3 mol•L-1•min-1 | B. | v (H2)=0.3mol•L-1•min-1 | ||
| C. | v(N2)=0.2 mol•L-1•min-1 | D. | v (N2)=0.05mol•L-1•s-1 |
| A. | 乙烯和甲烷都能发生加成反应 | |
| B. | 煤焦油、石油、花生油都属于烃 | |
| C. | 甲烷、乙烯、苯都可通过石油分馏得到 | |
| D. |  + +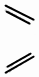 $\stackrel{△}{→}$ $\stackrel{△}{→}$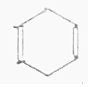 反应属于加成反应 反应属于加成反应 |
| A. | 中和热测定实验用的小烧杯和物质的量浓度溶液配制用的容量瓶都必须干燥 | |
| B. | 用已知浓度的盐酸滴定未知浓度的氢氧化钠溶液,若滴定终点时仰视读数,测得氢氧化钠浓度偏低 | |
| C. | 配制2.0 mol•L-1的硫酸,若定容时俯视,则所得溶液浓度偏高(其他操作均正确) | |
| D. | 用铜电极电解2.0 mol•L-1的硫酸,阴阳两极生成气体的体积之比为2:1 |
| A. | 气体的密度发生了变化 | B. | 气体的平均分子量发生了变化 | ||
| C. | 气体的颜色发生了变化 | D. | 体系的温度发生了变化 |