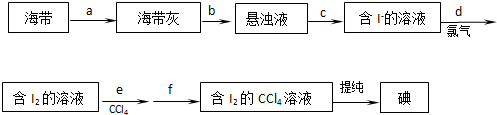
题目内容
10.如图,各烧杯中盛有海水,铁在其中被腐蚀时由快到慢的顺序是( )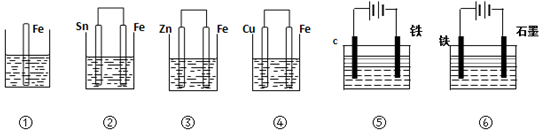
| A. | ④>②>①>③>⑤>⑥ | B. | ⑥>④>②>①>③>⑤ | C. | ④>②>⑤>③>⑥>① | D. | ⑥>③>②>④>①>⑤ |
分析 金属Fe发生腐蚀快慢顺序为:电解池阳极>原电池负极>化学腐蚀>原电池正极>电解池阴极,据此分析解答.
解答 解:金属Fe发生腐蚀快慢顺序为:电解池阳极>原电池负极>化学腐蚀>原电池正极>电解池阴极,
①中Fe发生化学腐蚀;
②中Fe作负极,加速被腐蚀;
③中Fe作正极,被保护;
④Fe作负极而加速被腐蚀,但其被腐蚀速率大于②;
⑤作电解池阴极,被保护;
⑥作电解池阳极而加速被腐蚀;
所以Fe被腐蚀快慢顺序是⑥>④>②>①>③>⑤,故选B.
点评 本题以金属腐蚀与防护为载体考查原电池和电解池原理,为高频考点,明确哪种电极被腐蚀、哪种电极被保护是解本题关键,注意:电化学腐蚀速率大于化学腐蚀速率.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
18.以下是对某水溶液进行SO42-离子检验的方法和结论,其中正确的是( )
| A. | 加入BaCl2溶液,产生了白色沉淀.则溶液中一定含有SO42- | |
| B. | 加入BaCl2溶液产生了白色沉淀,再加盐酸,沉淀不消失,则溶液中一定含有SO42- | |
| C. | 加入盐酸酸化的氯化钡溶液,产生白色沉淀,则溶液中一定有SO42- | |
| D. | 加入盐酸,溶液无明显现象,再加BaCl2溶液,产生了白色沉淀.则溶液中一定含有SO42- |
5.下列有关实验原理或操作不正确的是( )
| A. |  实验室制NH3 | B. | 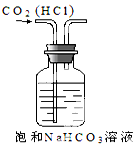 除去CO2中的HCl | C. |  检验K2CO3中的K+ | D. | 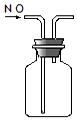 收集NO气体 |
2.在物质结构研究的历史上,首先提出原子结构有核模型的科学家是( )
| A. | 汤姆生 | B. | 玻尔 | C. | 卢瑟福 | D. | 普朗克 |