题目内容
3.O3氧化海水中的I-是大气中碘的主要来源,将O3通入稀硫酸酸化的NaI溶液中进行模拟研究.(1)为探究外界条件对I2生成速率的影响,做了如下三组实验,填写表中的空白处.
| 编号 | 实验目的 | 反应物 | 反应前 溶液的pH | 温度 |
| 1 | 对照组 | O3+NaI+H2SO4 | 5.2 | 25℃ |
| 2 | ①探究FeCl2对反应速率的影响 | O3+NaI+H2SO4+FeCl2 | 5.2 | 25℃ |
| 3 | 探究温度对反应速率的影响 | O3+NaI+H2SO4 | ②5.2 | 5℃ |
已知:①H2S2O3是一种弱酸;②2Na2S2O3+I2═Na2S4O6+2NaI
①该滴定实验中除烧杯、锥形瓶外,还需要的玻璃仪器是碱式滴定管;
②该实验中可选用淀粉(填物质名称)作指示剂.
③反应后溶液中碘的含量为6.35cVg•L-1.
④甲同学认为在滴定前应微热溶液,以排除溶液中溶解的O3和O2,不然会使滴定结果偏高(填“低”或“高”).
分析 (1)根据实验1、2中反应物的不同判断实验目的;根据实验3的实验目的,实验3中除了温度与实验1不同外,其它条件必须完全相同;
(2)①根据滴定操作方法判断使用的仪器,然后写出还缺少的仪器名称;
②反应中有碘单质参与,碘单质遇到淀粉显示蓝色,据此判断指示剂;
③根据反应2Na2S2O3+I2═Na2S4O6+2NaI及题中数据计算出碘单质的含量;
④氧气和臭氧能够氧化硫代硫酸钠,使消耗的硫代硫酸钠溶液体积偏大,测定结果偏高.
解答 解:(1)根据实验1、2的反应物可知,实验2的反应物多了氯化亚铁溶液,则实验2的目的是探究FeCl2对反应速率的影响;
实验3是探究温度对反应速率的影响,则除了温度不同以外,实验1、3中的其它条件必须完全相同,所以实验3的pH必须为5.2,
故答案为:①探究FeCl2对反应速率的影响;③5.2;
(2)①H2S2O3是一种弱酸,则硫代硫酸钠溶液显示碱性,滴定操作中,使用的玻璃仪器有:锥形瓶、烧杯和碱式滴定管,还缺少碱式滴定管,
故答案为:碱式滴定管;
②碘单质遇到淀粉显示蓝色,该滴定中有碘单质的参与,可以使用淀粉作为指示剂,
故答案为:淀粉;
③用c mol•L-1的Na2S2O3标准液滴定,消耗VmLNa2S2O3溶液,消耗硫代硫酸钠的物质的量为:cmol/L×0.001VL=0.001cVmol,
根据反应2Na2S2O3+I2═Na2S4O6+2NaI可知,反应后的溶液中含有碘单质的物质的量为:0.001cVmol×$\frac{1}{2}$=0.0005cVmol,碘单质的质量为:254g/mol×0.0005cVmol=0.127cvg,反应后的溶液中的含碘量为:$\frac{0.127cVg}{0.02L}$=6.35cVg/L,
故答案为:6.35cV;
④氧气和臭氧能够氧化硫代硫酸钠,如果不除去氧气和臭氧,滴定过程中消耗的硫代硫酸钠溶液的体积会偏大,计算出的碘单质的含量会偏高,
故答案为:高.
点评 本题考查了探究物质组成与含量的方法,题目难度中等,涉及影响化学反应速率的因素、中和滴定的操作方法及计算等知识,注意掌握体积影响化学反应速率的因素的方法,明确中和滴定的操作方法,试题培养了学生的分析、理解能力及化学实验、化学计算能力.

 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案| A. | Na2SiO3可用作助燃剂 | B. | SiO2可用作制造光导纤维 | ||
| C. | 单晶硅可用于制造太阳能电池 | D. | Si可用作制造变压器铁芯的原料 |
| A. | 1 mol•L-1 Na2CO3溶液中,含CO32-数目小于NA | |
| B. | 1molFeCl3完全转化为氢氧化铁胶体后,其中胶体粒子数目为NA | |
| C. | 25℃时,1L pH=12的Ba(OH)2溶液中含有的OH-数目为0.02 NA | |
| D. | 1 mol苯和苯甲酸的混合物完全燃烧时消耗O2的分子数为7.5NA |
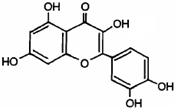
| A. | 在浓硫酸加热下,槲皮素可发生消去反应 | |
| B. | 槲皮素分子中不含手性碳原子 | |
| C. | 槲皮素的苯溶液加入浓溴水产生白色沉淀 | |
| D. | 1mol槲皮素最多可与5molNaOH发生中和反应 |
| 操作和现象 | 结论 | ||
| A | 向用盐酸酸化的FeCl2溶液的试管中加入少量NaNO2溶液,在管口观察到红棕色气体 | 主要原因是: H++NO2-=HNO2, 2HNO2=NO↑+NO2↑+H2O | |
| B | 向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2浊液,加热,没有红色沉淀生成. | 淀粉没有水解成葡萄糖 | |
| C | 向阿司匹林(乙酰水杨酸)中加足量饱和NaHCO3溶液,有大量气泡产生. | 阿司匹林彻底水解 | |
| D | 苯酚钠溶液中通入足量二氧化碳产生浑浊 | 苯酚的酸性弱于碳酸 | |
| A. | A | B. | B | C. | C | D. | D |
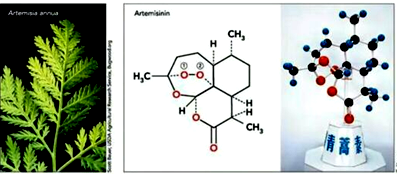
| A. | 青蒿素极易溶于水 | |
| B. | 1 mol青蒿素与足量NaOH溶液反应最多消耗4 mol NaOH | |
| C. | 青蒿素含有过氧键,有较强氧化性 | |
| D. | 青蒿素分子式为C15H21O5 |
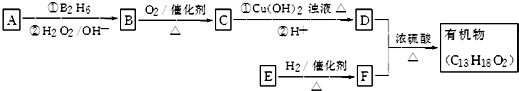
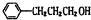 .
.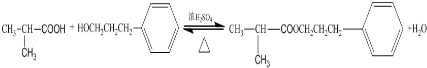 ;其反应类型是取代反应.
;其反应类型是取代反应.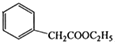 )是一种重要的医药中间体.写出以苯乙酮(
)是一种重要的医药中间体.写出以苯乙酮(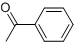 )和乙醇为主要原料制备苯乙酸乙酯的合成路线流程图(无机试剂任选).
)和乙醇为主要原料制备苯乙酸乙酯的合成路线流程图(无机试剂任选). 按如图所示,两个烧杯中分别盛有足量的稀硫酸溶液和氯化铜溶液:
按如图所示,两个烧杯中分别盛有足量的稀硫酸溶液和氯化铜溶液: