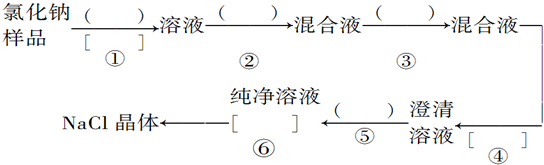
题目内容
13.(1)将4gNaOH溶于多少克水中,才能使每100个H2O分子溶有一个Na+?(2)计算4.2gCO在标准状况下的体积.
求标准状况下8.96LCO2的质量.
分析 (1)先利用n=$\frac{m}{M}$计算物质的量,再利用物质的量之比等于个数之比来计算;
(2)根据n=nVm=$\frac{m}{M}$Vm计算出4.2g一氧化碳在标准状况下的体积;根据m=nM=$\frac{V}{{V}_{m}}$M计算出标准状况下8.96LCO2的质量.
解答 解:(1)NaOH的物质的量为:$\frac{4g}{40g/mol}$=0.1mol,设水的物质的量为x,由每100个H2O分子溶有一个Na+,则$\frac{100}{1}$=$\frac{x}{0.1mol}$,解得:x=10mol,则需要水的质量为:10mol×18g/mol=180g,
答:4g NaOH溶于180克水中,才能使每100个H2O分子溶有一个Na+;
(2)4.2gCO的物质的量为:$\frac{4.2g}{28g/mol}$=0.15mol,标准状况下0.15molCO的体积为:22.4L/mol×0.15mol=3.36L;
标准状况下8.96L二氧化碳的物质的量为:$\frac{8.96L}{22.4L/mol}$=0.4mol,0.4mol二氧化碳的质量为:44g/mol×0.4mol=17.6g,
答:4.2gCO在标准状况下的体积为3.36L,标准状况下8.96LCO2的质量为17.6g.
点评 本题考查了物质的量的计算,题目难度中等,明确物质的量与气体摩尔体积、摩尔质量、阿伏伽德罗常数之间的关系为解答关键,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
3.把NaOH和Na2CO3混和物配制成100mL溶液,其中c(Na+)=0.5mol/L.在该溶液中加入过量盐酸反应完全后,将溶液蒸干后所得固体质量为( )
| A. | 2.93 g | B. | 5.85 g | C. | 6.56g | D. | 无法确定 |
4.下列物质不能使蛋白质变性的是( )
| A. | 紫外线 | B. | 福尔马林 | C. | 硫酸钠 | D. | 浓盐酸 |
8.下列叙述中正确的是( )
| A. | Cu和足量的稀硝酸反应产生4.48 L气体时,转移的电子数为0.6×6.02×1023 | |
| B. | 常温常压下,8.8 g CO2和N2O混合物中所含有的原子总数为0.6×6.02×1023 | |
| C. | 标准状况下,3.36 L己烷中含有的分子数目为0.15×6.02×1023 | |
| D. | 在1 L 0.2 mol/L的硫酸铁溶液中含有的三价铁离子数为0.4×6.02×1023 |
20.如表列出了A-G 7种元素在周期表中的位置
(1)这7种元素中化学性质最不活泼的是Al(填元素符号)
(2)D元素的最高价氧化物对应水化物与氢氧化钠反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O
(3)A、B、C三种元素按原子半径由大到小的顺序排列为K>Na>Mg(填元素符号)
(4)E元素氢化物的结构式是H-O-H,该氢化物在常温下跟B发生反应的化学方程式是2K+2H2O=2KOH+H2↑.
(5)F元素跟A元素形成化合物的电子式是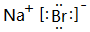 ,高温灼烧该化合物时,火焰呈黄色.
,高温灼烧该化合物时,火焰呈黄色.
(6)C.D的单质作电极,稀硫酸作电解质溶液,构成原电池.其负极的电极反应式为:Mg-2e-=Mg2+.
| 周期\族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 2 | E | |||||||
| 3 | A | C | D | G | ||||
| 4 | B | F |
(2)D元素的最高价氧化物对应水化物与氢氧化钠反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O
(3)A、B、C三种元素按原子半径由大到小的顺序排列为K>Na>Mg(填元素符号)
(4)E元素氢化物的结构式是H-O-H,该氢化物在常温下跟B发生反应的化学方程式是2K+2H2O=2KOH+H2↑.
(5)F元素跟A元素形成化合物的电子式是
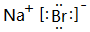 ,高温灼烧该化合物时,火焰呈黄色.
,高温灼烧该化合物时,火焰呈黄色.(6)C.D的单质作电极,稀硫酸作电解质溶液,构成原电池.其负极的电极反应式为:Mg-2e-=Mg2+.
1.将pH=1的稀硫酸慢慢加入一定量的BaCl2的溶液中,恰好使Ba2+沉淀完全,此时溶液的体积为100mL(混合时溶液体积的变化忽略不计),且混合溶液的pH=2,则原BaCl2溶液中Cl-的浓度约为( )
| A. | 0.22 mol/L | B. | 0.11 mol/L | C. | 0.022 mol/L | D. | 0.011 mol/L |