题目内容
18.请写出符合题意的粒子,(可以是原子也可以是分子、离子):(1)核外电子总数为2的粒子He,Li+,H2等;
(2)核外电子总数为10的粒子Ne,Na+,HF等;
(3)核外电子总数为18的粒子Ar,K+,HCl等.
分析 根据原子或者分子:核外电子数=质子数;
阳离子:核外电子数=质子数-所带电荷数;
阴离子:核外电子数=质子数+所带电荷数.
解答 解:原子或者分子:核外电子数=质子数;
阳离子:核外电子数=质子数-所带电荷数;
阴离子:核外电子数=质子数+所带电荷数.
(1)核外电子总数为2的原子为He,离子为Li+,分子为H2,故答案为:He,Li+,H2等;
(2)核外电子总数为10的粒子原子为Ne,离子为Na+,分子为HF等,故答案为:Ne,Na+,HF等;
(3)核外电子总数为18的粒子原子为Ar,离子为K+,分子为HCl等,故答案为:Ar,K+,HCl等.
点评 本题考查粒子核外电子数的计算,注意原子或者分子:核外电子数=质子数;阳离子:核外电子数=质子数-所带电荷数;阴离子:核外电子数=质子数+所带电荷数,难度不大.

练习册系列答案
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
8.下列化学用语书写正确的是( )
| A. | 氯原子的结构示意图: | |
| B. | 氯化镁的电子式: | |
| C. | N2的电子式: | |
| D. | 用电子式表示氯化氢分子的形成过程: |
6.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 常温常压下,8 g CH4含有4NA个氢原子 | |
| B. | 2gD216O中含有的质子数为2NA个 | |
| C. | 1 mol Cu与足量FeCl3溶液反应,转移2NA个电子 | |
| D. | 通常状况下,2.24 L氮气含有0.1NA个N2分子 |
1.在一定温度下,将0.20mol 的四氧化二氮气体充入1L的固定的密闭容器中,每隔一段时间对该容器内的物质进行一次分析,得到如下数据:
根据表格提供数据,请回答下列各小题:
(1)该反应的化学方程式为:N2O4?2NO2,表示C2>C3=C4 (填<,>或=)
(2)20s时,四氧化二氮的浓度C1=0.14mol/L,在0~20s内四氧化二氮的平均反应速度为0.003mol/(L•s).
时间 (s)浓度 mol•L-1 | 0 | 20 | 40 | 60 | 80 | 100 |
| C(N2O4) | 0.20 | C1 | 0.10 | C3 | C4 | C5 |
| C(NO2) | 0.00 | 0.12 | C2 | 0.22 | 0.22 | 0.22 |
(1)该反应的化学方程式为:N2O4?2NO2,表示C2>C3=C4 (填<,>或=)
(2)20s时,四氧化二氮的浓度C1=0.14mol/L,在0~20s内四氧化二氮的平均反应速度为0.003mol/(L•s).
8.TiO2和TiCl4都是钛的重要化合物,某化学兴趣小组在实验室对两者的制备及性质进行探究.
Ⅰ.制备TiCl4
实验室利用反应TiO2 (s)+CCl4(g)$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,装置图和有关信息如下:

请回答下列问题:
(1)仪器A的名称是球形干燥管.
(2)实验开始前后的操作包括:①检查装置气密性,②组装仪器,③通N2一段时间,④加装药品,⑤点燃酒精灯⑥停止通N2⑦停止加热.正确的操作顺序是②①④③⑤⑦⑥
实验结束后欲分离D中的液态混合物,所采用操作的名称是蒸馏(或分馏).
(3)装置E能否不能(填“能”或“不能”)换成装置A,理由是装置A不能吸收空气中的氧气,不能保证反应在无氧环境下进行
(4)TiCl4是制取航天航空工业材料--钛合金的重要原料.某钛合金的元素还有Al和Si等,已知在常温下,钛是一种耐强酸强碱的金属,请设计实验检验其中的Si元素.
取少量合金样品于试管中,滴加过量NaOH溶液,振荡,静置后取上层清液,再逐滴滴入稀盐酸至过量,若有沉淀产生且最终沉淀不完全溶解,则证明样品中有Si
Ⅱ.制备TiO2及测定TiO2的质量分数:
在TiCl4中加水、加热,水解得到沉淀TiO2•xH2O,经过滤、水洗,再烘干、焙烧除去水分得到粉体TiO2.
(5)写出生成TiO2•xH2O的化学方程式TiCl4+(x+2)H2O$\frac{\underline{\;\;△\;\;}}{\;}$TiO2•xH2O↓+4HCl.
(6)检验沉淀是否洗涤干净的方法是取最后一次洗涤液于试管中加入硝酸酸化的AgNO3若没有产生沉淀,则已洗干净.
(7)一定条件下,将TiO2溶解并还原为Ti3+,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+.滴定分析时,称取上述TiO2试样0.2g,消耗0.1mol•L-1 NH4Fe(SO4)2标准溶液20mL
①配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的目的是:抑制NH4Fe(SO4)2水解.
②该滴定操作所用到的指示剂是KSCN溶液.
③则TiO2质量分数为80%.
Ⅰ.制备TiCl4
实验室利用反应TiO2 (s)+CCl4(g)$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,装置图和有关信息如下:

| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
(1)仪器A的名称是球形干燥管.
(2)实验开始前后的操作包括:①检查装置气密性,②组装仪器,③通N2一段时间,④加装药品,⑤点燃酒精灯⑥停止通N2⑦停止加热.正确的操作顺序是②①④③⑤⑦⑥
实验结束后欲分离D中的液态混合物,所采用操作的名称是蒸馏(或分馏).
(3)装置E能否不能(填“能”或“不能”)换成装置A,理由是装置A不能吸收空气中的氧气,不能保证反应在无氧环境下进行
(4)TiCl4是制取航天航空工业材料--钛合金的重要原料.某钛合金的元素还有Al和Si等,已知在常温下,钛是一种耐强酸强碱的金属,请设计实验检验其中的Si元素.
取少量合金样品于试管中,滴加过量NaOH溶液,振荡,静置后取上层清液,再逐滴滴入稀盐酸至过量,若有沉淀产生且最终沉淀不完全溶解,则证明样品中有Si
Ⅱ.制备TiO2及测定TiO2的质量分数:
在TiCl4中加水、加热,水解得到沉淀TiO2•xH2O,经过滤、水洗,再烘干、焙烧除去水分得到粉体TiO2.
(5)写出生成TiO2•xH2O的化学方程式TiCl4+(x+2)H2O$\frac{\underline{\;\;△\;\;}}{\;}$TiO2•xH2O↓+4HCl.
(6)检验沉淀是否洗涤干净的方法是取最后一次洗涤液于试管中加入硝酸酸化的AgNO3若没有产生沉淀,则已洗干净.
(7)一定条件下,将TiO2溶解并还原为Ti3+,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+.滴定分析时,称取上述TiO2试样0.2g,消耗0.1mol•L-1 NH4Fe(SO4)2标准溶液20mL
①配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的目的是:抑制NH4Fe(SO4)2水解.
②该滴定操作所用到的指示剂是KSCN溶液.
③则TiO2质量分数为80%.
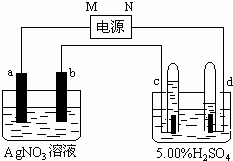 如图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极.通电一段时间后,在c、d两极上共收集到336mL(标准状态)气体.请回答下列问题.
如图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极.通电一段时间后,在c、d两极上共收集到336mL(标准状态)气体.请回答下列问题. .
.