题目内容
下列反应最后能产生沉淀的是( )
| A、向A1C13溶液中加过量NaOH溶液 |
| B、向NaAlO2溶液中加过量盐酸 |
| C、向KOH溶液中加过量的Al2(S04)3溶液 |
| D、向BaCl2溶液中通人少量CO2 |
考点:镁、铝的重要化合物
专题:
分析:A、氢氧化铝具有两性,能与强碱反应;
B、氢氧化铝具有两性,能与强酸反应;
C、虽然氢氧化铝具有两性,但向KOH溶液中加过量的Al2(S04)3溶液,因为铝离子过量,则生成的氢氧化铝沉淀不会溶解;
D、碳酸的酸性比盐酸弱.
B、氢氧化铝具有两性,能与强酸反应;
C、虽然氢氧化铝具有两性,但向KOH溶液中加过量的Al2(S04)3溶液,因为铝离子过量,则生成的氢氧化铝沉淀不会溶解;
D、碳酸的酸性比盐酸弱.
解答:
解:A、氢氧化铝具有两性,NaOH过量,生成NaAlO2,得不到氢氧化铝沉淀,故A错误;
B、氢氧化铝具有两性,盐酸过量,生成AlCl3,得不到氢氧化铝沉淀,故B错误;
C、虽然氢氧化铝具有两性,但向KOH溶液中加过量的Al2(S04)3溶液,因为铝离子过量,则生成的氢氧化铝沉淀不会溶解,故C正确;
D、碳酸的酸性比盐酸弱,故氯化钡与二氧化碳不发生反应,故D错误;
故选:D.
B、氢氧化铝具有两性,盐酸过量,生成AlCl3,得不到氢氧化铝沉淀,故B错误;
C、虽然氢氧化铝具有两性,但向KOH溶液中加过量的Al2(S04)3溶液,因为铝离子过量,则生成的氢氧化铝沉淀不会溶解,故C正确;
D、碳酸的酸性比盐酸弱,故氯化钡与二氧化碳不发生反应,故D错误;
故选:D.
点评:本题重点考查了氢氧化铝的两性,能溶于强酸、强碱,不溶于弱酸、弱碱,金属的重要化合物是高考热点题型,每年高考必考.

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案
相关题目
可逆反应2A(g)+3B(g)?2C(g);△H=-QkJ?mol-1(Q>0).现有甲、乙两个容积相同且不变的真空密闭容器,向甲容器中加入2molA和3molB,在一定条件下达到平衡时放出热量为Q1kJ;在相同的条件下,向乙容器中加入2molC达到平衡后吸收热量为Q2 kJ;已知2Q1=Q2.下列叙述正确的( )
| A、平衡时甲、乙中C的体积分数甲>乙 |
| B、平衡时甲中A的转化率为60% |
| C、达到平衡后,再向乙中加入0.8molA+1.2molB+1.2molC,平衡向生成A的正向移动 |
| D、D甲容器达到平衡后,升温,反应的平衡常数增大 |
下列说法不正确的是( )
| A、在干冰晶体中,与一个CO2分子相邻且等距离的CO2分子共有12个 |
| B、在SiO2晶体中,若含有1molSi原子,则Si-O键数为4NA |
| C、在金刚石晶体中,一个碳原子被12个六元碳环所共用,一个C-C键最多可形成6个六元环,一个六元环实际拥有一个碳原子 |
| D、mg石墨中,正六边形数目为m NA/24,每个环拥有碳原子数与C-C键数之比为2:3 |
现有一定量的Cu和Fe2O3组成的混合物,平均分成两等分,向其中一份加入2mol?L-1的盐酸溶液150mL,恰好完全溶解,所得溶液加入KSCN无血红色出现.若用过量的CO在高温下还原原混合物,固体质量减少为( )
| A、1.6 g |
| B、2.4 g |
| C、3.2 g |
| D、4.8 g |
铁镍蓄电池又称爱迪生电池,放电时的总反应为:Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2下列有关该电池的说法不正确的是( )
| A、电池的电解质溶液为碱性溶液,正极为Ni2O3、负极为Fe |
| B、电池放电时,负极反应为Fe+2OH--2e-=Fe(OH)2 |
| C、电池放电过程中,溶液中的OH-向负极移动 |
| D、电池放电与充电过程发生的化学反应是可逆反应 |
 如图所示甲、乙两个装置,所盛溶液体积和浓度均相同且足量,当两装置电路中通过的电子都是1mol时,下列说法不正确的是( )
如图所示甲、乙两个装置,所盛溶液体积和浓度均相同且足量,当两装置电路中通过的电子都是1mol时,下列说法不正确的是( )| A、溶液的质量变化:甲减小乙增大 |
| B、溶液pH变化:甲减小乙增大 |
| C、相同条件下产生气体的体积:V甲=V乙 |
| D、电极反应式:甲中阴极为Cu2++2e-═Cu,乙中负极为Mg-2e-═Mg2+ |
下列叙述正确的是( )
| A、用热的纯溶液清洗油污的原理可表示为:CO3 2-+H2O?HCO3-+OH- |
| B、0.1 mol?L-1的NaHCO3溶液中:K+、Al 3+、Fe3+、NO3- 可大量存在 |
| C、室温下,某溶液中只含有Al 3+、K+、NO3-、SO4 2-,则该溶液由水电离出的c(H+ )=10-13 mol?L-1 |
| D、可以用加热蒸干并充分灼烧的方法得到CuCl2溶液的溶质固体 |
已知:MOH为一元弱碱,2MOH(aq)+H2SO4(aq)=M2SO4(aq)+2H2O(l)△H1=-24.2kJ?mol-1H+(aq)+OH-(aq)=H2O(l)△H2=-57.3kJ?mol-1则MOH在水溶液中电离的△H为( )
| A、+33.1kJ?mol-1 |
| B、-81.5 kJ?mol-1 |
| C、+45.2 kJ?mol-1 |
| D、-33.1 kJ?mol-1 |
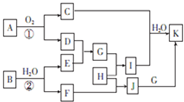 物质A~K有如图所示的转化关系(反应条件及部分产物未列出)其中A由两种元素组成,且两种元素的质量之比为7:8,B是非金属固态单质,G是金属单质,H是黄绿色气体,D为红棕色固体,C是形成酸雨的主要气体.
物质A~K有如图所示的转化关系(反应条件及部分产物未列出)其中A由两种元素组成,且两种元素的质量之比为7:8,B是非金属固态单质,G是金属单质,H是黄绿色气体,D为红棕色固体,C是形成酸雨的主要气体.