题目内容
现有一定量的Cu和Fe2O3组成的混合物,平均分成两等分,向其中一份加入2mol?L-1的盐酸溶液150mL,恰好完全溶解,所得溶液加入KSCN无血红色出现.若用过量的CO在高温下还原原混合物,固体质量减少为( )
| A、1.6 g |
| B、2.4 g |
| C、3.2 g |
| D、4.8 g |
考点:铁的氧化物和氢氧化物,化学方程式的有关计算,铜金属及其重要化合物的主要性质
专题:几种重要的金属及其化合物
分析:向一定质量的Cu和Fe2O3的混合物中加入150mL 2mol/L的HCl溶液,恰好使混合物完全溶解,向所得溶液中加入KSCN溶液后,无血红色出现,溶液中没有铁离子,发生反应Fe2O3+6HCl=2FeCl3+3H2O,Cu+2FeCl3=2FeCl2+CuCl2,最终溶液中溶质为FeCl2、CuCl2,且二者物质的量之比为2:1,根据氯离子守恒计算n(FeCl2),再根据Fe元素守恒计算n(Fe2O3),混合物用过量的CO发生反应:Fe2O3+3CO
2Fe+3CO2,固体减少质量等于Fe2O3中氧元素的质量.
| ||
解答:
解:向一定质量的Cu和Fe2O3的混合物中加入300mL 2mol/L的HCl溶液,恰好使混合物完全溶解,向所得溶液中加入KSCN溶液后,无血红色出现,溶液中没有铁离子,发生反应Fe2O3+6HCl=2FeCl3+3H2O,Cu+2FeCl3=2FeCl2+CuCl2,最终溶液中溶质为FeCl2、CuCl2,且二者物质的量之比为2:1,
根据氯离子守恒:2n(FeCl2)+
n(FeCl2)×2=0.15L×2mol/L,解得n(FeCl2)=0.1mol,根据Fe元素守恒可知n(Fe2O3)=0.05mol,
混合物用过量的CO发生反应:Fe2O3+3CO
2Fe+3CO2,固体减少质量等于Fe2O3中氧元素的质量,故固体减少质量=0.05mol×3×16g/mol=2.4g,
故选B.
根据氯离子守恒:2n(FeCl2)+
| 1 |
| 2 |
混合物用过量的CO发生反应:Fe2O3+3CO
| ||
故选B.
点评:本题考查混合物计算,明确发生的反应是解题关键,注意根据方程式确定溶液中氯化亚铁、氯化铜的物质的量关系,注意守恒思想的应用,难度中等.

练习册系列答案
相关题目
如图装置进行实验,将液体A逐滴加入到固体B中,下列叙述正确的是( )
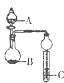

| A、若A为醋酸,B为贝壳,C中盛CaCl2溶液,则C中溶液变浑浊 |
| B、若A为浓硫酸,B为木炭,C中盛有硅酸钠溶液,则C中出现白色浑浊 |
| C、若A为浓盐酸,B为MnO2,C中盛石蕊试液,则C中溶液先变红后褪色 |
| D、若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生白色沉淀后沉淀不溶解 |
现有A和B的液态混合物,已知A和B的一些性质如下所示:根据图中的数据,分离A和B的液态混合物的最佳方法是( )
| 物质 | 熔点 | 沸点 | 密度 | 在水中的溶解性 |
| A | -97℃ | 86.8℃ | 0.91g/cm3 | 可溶 |
| B | -95℃ | 54.6℃ | 0.89g/cm3 | 可溶 |
| A、过滤法 | B、蒸馏法 |
| C、萃取法 | D、分液法 |
根据盖斯定律判断如图所示的物质转变过程中,△H1、△H2、△H3、△H4的正确关系是( )

| A、△H1=△H2=△H3=△H4 |
| B、△H1-△H2-△H3=△H4 |
| C、△H1-△H3=△H2-△H4 |
| D、△H1>△H2>△H3>△H4 |
下列反应最后能产生沉淀的是( )
| A、向A1C13溶液中加过量NaOH溶液 |
| B、向NaAlO2溶液中加过量盐酸 |
| C、向KOH溶液中加过量的Al2(S04)3溶液 |
| D、向BaCl2溶液中通人少量CO2 |
海水中含有氯化镁,是镁的重要来源之一.从海水中制取镁,可按如下步骤进行:①把贝壳制成石灰乳 ②在引入的海水中加石灰乳,沉降、过滤、洗涤沉淀物 ③将沉淀物与盐酸反应,结晶、过滤、干燥产物 ④将得到的产物熔融后电解.关于从海水中提取镁,下列说法不正确的是( )
| A、此法的优点之一是原料来源丰富 |
| B、进行①②③步骤的目的是从海水中提取氯化镁 |
| C、第④步电解制镁是由于镁是很活泼的金属 |
| D、以上制取镁的过程中涉及的反应有分解反应、化合反应和置换反应 |
常温下,在20mL0.1mol?L-1Na2CO3溶液中逐渐滴入0.1mol?L-1HCl溶液40mL,溶液的PH逐渐降低,下列说法正确的是( )
| A、完全反应以后,溶液呈现中性 |
| B、当盐酸加入10mL时,溶液中:c(CO32-)=C(HCO3-) |
| C、在20mL0.1mol?L-1Na2CO3溶液中:c(H+)+2c(H2CO3)+c(HCO3-)=c(OH-) |
| D、当盐酸加入20mL时,溶液中:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-) |