题目内容
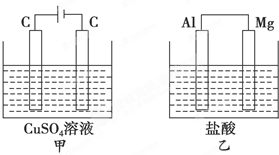 如图所示甲、乙两个装置,所盛溶液体积和浓度均相同且足量,当两装置电路中通过的电子都是1mol时,下列说法不正确的是( )
如图所示甲、乙两个装置,所盛溶液体积和浓度均相同且足量,当两装置电路中通过的电子都是1mol时,下列说法不正确的是( )| A、溶液的质量变化:甲减小乙增大 |
| B、溶液pH变化:甲减小乙增大 |
| C、相同条件下产生气体的体积:V甲=V乙 |
| D、电极反应式:甲中阴极为Cu2++2e-═Cu,乙中负极为Mg-2e-═Mg2+ |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:甲中总反应为:2CuSO4+2H2O
2Cu+2H2SO4+O2↑,乙中总反应为:Mg+2HCl=MgCl2+H2↑,故甲溶液质量减小,乙溶液质量增大;甲中生成H2SO4,pH减小,乙中消耗HCl,pH增大;当两装置电路中通过的电子都是1mol时,甲中产生0.25molO2,乙中产生0.5molH2;甲中阴极为Cu2+放电,电极反应为Cu2++2e-=Cu,乙中负极为Mg放电,电极反应为:Mg-2e-=Mg2-.
| ||
解答:
解:A、甲中总反应为:2CuSO4+2H2O
2Cu+2H2SO4+O2↑,乙中总反应为:Mg+2HCl=MgCl2+H2↑,故甲溶液质量减小,乙溶液质量增大,故A正确;
B、甲中生成H2SO4,pH减小,乙中消耗HCl,pH增大,故B正确;
C、当两装置电路中通过的电子都是1mol时,甲中产生0.25molO2,乙中产生0.5molH2,故相同条件下,甲乙中产生气体的体积比为1:2,故C错误;
D、甲中阴极为Cu2+放电,电极反应为Cu2++2e-=Cu,乙中负极为Mg放电,电极反应为:Mg-2e-=Mg2-,故D正确;.
故选C.
| ||
B、甲中生成H2SO4,pH减小,乙中消耗HCl,pH增大,故B正确;
C、当两装置电路中通过的电子都是1mol时,甲中产生0.25molO2,乙中产生0.5molH2,故相同条件下,甲乙中产生气体的体积比为1:2,故C错误;
D、甲中阴极为Cu2+放电,电极反应为Cu2++2e-=Cu,乙中负极为Mg放电,电极反应为:Mg-2e-=Mg2-,故D正确;.
故选C.
点评:本题考查原电池和电解池的原理,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
现有A和B的液态混合物,已知A和B的一些性质如下所示:根据图中的数据,分离A和B的液态混合物的最佳方法是( )
| 物质 | 熔点 | 沸点 | 密度 | 在水中的溶解性 |
| A | -97℃ | 86.8℃ | 0.91g/cm3 | 可溶 |
| B | -95℃ | 54.6℃ | 0.89g/cm3 | 可溶 |
| A、过滤法 | B、蒸馏法 |
| C、萃取法 | D、分液法 |
下列反应最后能产生沉淀的是( )
| A、向A1C13溶液中加过量NaOH溶液 |
| B、向NaAlO2溶液中加过量盐酸 |
| C、向KOH溶液中加过量的Al2(S04)3溶液 |
| D、向BaCl2溶液中通人少量CO2 |
海水中含有氯化镁,是镁的重要来源之一.从海水中制取镁,可按如下步骤进行:①把贝壳制成石灰乳 ②在引入的海水中加石灰乳,沉降、过滤、洗涤沉淀物 ③将沉淀物与盐酸反应,结晶、过滤、干燥产物 ④将得到的产物熔融后电解.关于从海水中提取镁,下列说法不正确的是( )
| A、此法的优点之一是原料来源丰富 |
| B、进行①②③步骤的目的是从海水中提取氯化镁 |
| C、第④步电解制镁是由于镁是很活泼的金属 |
| D、以上制取镁的过程中涉及的反应有分解反应、化合反应和置换反应 |
常温下,用 0.10mol?L-1 NaOH溶液分别滴定20.00mL 0.10mol?L-1 HCl溶液和20.00mL 0.10mol?L-1 CH3COOH溶液,得到2条滴定曲线,如图所示,则下列说法正确的是( )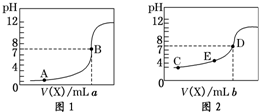

| A、图2是滴定盐酸的曲线 |
| B、a与b的关系是:a<b |
| C、E点对应离子浓度由大到小的顺序为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| D、这两次滴定都可以用甲基橙作为指示剂且颜色变化为红变橙 |
常温下,在20mL0.1mol?L-1Na2CO3溶液中逐渐滴入0.1mol?L-1HCl溶液40mL,溶液的PH逐渐降低,下列说法正确的是( )
| A、完全反应以后,溶液呈现中性 |
| B、当盐酸加入10mL时,溶液中:c(CO32-)=C(HCO3-) |
| C、在20mL0.1mol?L-1Na2CO3溶液中:c(H+)+2c(H2CO3)+c(HCO3-)=c(OH-) |
| D、当盐酸加入20mL时,溶液中:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-) |
下列说法正确的是( )
A、将25℃纯水加热至95℃时,
| ||||
B、将pH=11的Na2CO3溶液加水稀释,
| ||||
| C、室温下,pH=a的盐酸与pH=b的氨水等体积混合后pH=7,则a+b=14 | ||||
| D、0.1mol?L-1酸HA与0.1mol?L-1NaOH溶液等体积混合后pH>7,则c(Na+)═c(A-)+c(HA)═0.1mol?L- |
下列与化学反应能量变化相关的叙述正确的是( )
| A、对于反应CO(g)+H2O(g)?CO2(g)+H2(g)△H<0,在其他条件不变的情况下,改变压强,平衡不发生移动,反应放出的热量不变 |
| B、同温同压下,H2(g)+Cl2═2HCl(g)在光照和点燃条件下的焓变不同 |
| C、甲烷的标准燃烧热为-890.3KJ?mol-1,则甲烷的燃烧热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3KJ?mol-1 |
| D、500℃,30MPa下,将0.5mol N2和1.5mol H2置于密闭容器中充分反应生成NH3气体,放热19.3KJ,其热化学方程式为:N2(g)+3H2?2NH3(g)△H=-38.6KJ?mol-1 |





