题目内容
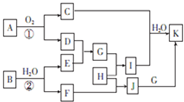 物质A~K有如图所示的转化关系(反应条件及部分产物未列出)其中A由两种元素组成,且两种元素的质量之比为7:8,B是非金属固态单质,G是金属单质,H是黄绿色气体,D为红棕色固体,C是形成酸雨的主要气体.
物质A~K有如图所示的转化关系(反应条件及部分产物未列出)其中A由两种元素组成,且两种元素的质量之比为7:8,B是非金属固态单质,G是金属单质,H是黄绿色气体,D为红棕色固体,C是形成酸雨的主要气体.(1)写出下列物质的化学式:C
(2)反应②的化学方程式为
(3)常温下,向I溶液中滴加NaOH溶液至溶液的pH=4产生沉淀,此时测得溶液中I的阳离子的物质的量浓度为3.8×10-8mol?L-1,则其氢氧化物的溶度积常数为
(4)C与I的反应中氧化剂与还原剂的物质的量之比为
(5)在化工生产中毎燃烧0.12kgA就会放出853kJ的热量,则A燃烧的热化学方程式为
考点:无机物的推断
专题:推断题
分析:H是黄绿色气体,应为Cl2,D为红棕色固体,为Fe2O3,C是形成酸雨的主要气体,为SO2,则A由Fe、S两种元素组成,且两种元素的质量之比为7:8,应为FeS2,则G为Fe,则E应为还原性气体,结合B为非金属固体单质可知B应为C(碳),则E为CO,F为H2,I为FeCl3,J为HCl,K为FeCl2,结合对应物质的性质以及题目要求解答该题.
解答:
解:H是黄绿色气体,应为Cl2,D为红棕色固体,为Fe2O3,C是形成酸雨的主要气体,为SO2,则A由Fe、S两种元素组成,且两种元素的质量之比为7:8,应为FeS2,则G为Fe,则E应为还原性气体,结合B为非金属固体单质可知B应为C(碳),则E为CO,F为H2,I为FeCl3,J为HCl,K为FeCl2,
(1)由以上分析可知C为SO2,H为Cl2,K为FeCl2,故答案为:SO2;Cl2;FeCl2;
(2)反应②为C和水的反应,方程式为C+H2O
CO+H2,故答案为:C+H2O
CO+H2;
(3)I为FeCl3,加入NaOH溶液生成Fe(OH)3,Ksp(Fe(OH)3)=c(Fe3+)×c3(OH-)=3.8×10-8×(10-10)3=3.8×10-38,
故答案为:3.8×10-38;
(4)C与I的反应的SO2+2Fe3++2H2O=2Fe2++SO42-+4H+,反应中氧化剂与还原剂的物质的量之比为2:1,故答案为:2:1;
(5)在化工生产中毎燃烧0.12kgFeS2就会放出853kJ的热量,即燃烧1molFeS2就会放出853kJ的热量,则4mol放出3412kJ的热量,
则热化学方程式为4FeS2(s)+11O2(g)=8SO2(g)+2Fe2O3(s)△H=-3412kJ/mol,
故答案为:4FeS2(s)+11O2(g)=8SO2(g)+2Fe2O3(s)△H=-3412kJ/mol.
(1)由以上分析可知C为SO2,H为Cl2,K为FeCl2,故答案为:SO2;Cl2;FeCl2;
(2)反应②为C和水的反应,方程式为C+H2O
| ||
| ||
(3)I为FeCl3,加入NaOH溶液生成Fe(OH)3,Ksp(Fe(OH)3)=c(Fe3+)×c3(OH-)=3.8×10-8×(10-10)3=3.8×10-38,
故答案为:3.8×10-38;
(4)C与I的反应的SO2+2Fe3++2H2O=2Fe2++SO42-+4H+,反应中氧化剂与还原剂的物质的量之比为2:1,故答案为:2:1;
(5)在化工生产中毎燃烧0.12kgFeS2就会放出853kJ的热量,即燃烧1molFeS2就会放出853kJ的热量,则4mol放出3412kJ的热量,
则热化学方程式为4FeS2(s)+11O2(g)=8SO2(g)+2Fe2O3(s)△H=-3412kJ/mol,
故答案为:4FeS2(s)+11O2(g)=8SO2(g)+2Fe2O3(s)△H=-3412kJ/mol.
点评:本题考查无机物的推断,为高考常见题型,侧重于学生的分析能力的考查,本题注意把握物质的特性以及反应的转化关系,为解答该题的关键,难度中等.

练习册系列答案
相关题目
下列有关铁丝在氯气中燃烧的说法中正确的是( )
| A、剧烈燃烧,产生大量白烟 |
| B、产生棕红色的浓烟 |
| C、产生苍白色的火焰 |
| D、产物溶于水,溶液呈浅绿色 |
如图装置进行实验,将液体A逐滴加入到固体B中,下列叙述正确的是( )
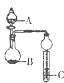

| A、若A为醋酸,B为贝壳,C中盛CaCl2溶液,则C中溶液变浑浊 |
| B、若A为浓硫酸,B为木炭,C中盛有硅酸钠溶液,则C中出现白色浑浊 |
| C、若A为浓盐酸,B为MnO2,C中盛石蕊试液,则C中溶液先变红后褪色 |
| D、若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生白色沉淀后沉淀不溶解 |
在一密闭容器中有如下反应:aX(g)+bY(g)?nW(g)△H,某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如下曲线图:其中,φ(W)表示W在反应混合物中的体积分数,t表示反应时间.当其他条件不变时,下列分析正确的是( )
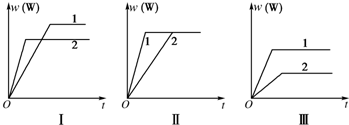
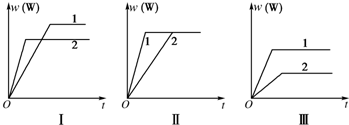
| A、图Ⅰ可能是不同压强对反应的影响,且p1>p2,a+b<n |
| B、图Ⅱ可能是不同压强对反应的影响,且p1>p2,n<a+b |
| C、图Ⅱ可能是在同温同压下不同催化剂对反应的影响,且1使用的催化剂效果好 |
| D、图Ⅲ可能是不同温度对反应的影响,且T1>T2,△H<0 |
现有A和B的液态混合物,已知A和B的一些性质如下所示:根据图中的数据,分离A和B的液态混合物的最佳方法是( )
| 物质 | 熔点 | 沸点 | 密度 | 在水中的溶解性 |
| A | -97℃ | 86.8℃ | 0.91g/cm3 | 可溶 |
| B | -95℃ | 54.6℃ | 0.89g/cm3 | 可溶 |
| A、过滤法 | B、蒸馏法 |
| C、萃取法 | D、分液法 |
下列反应最后能产生沉淀的是( )
| A、向A1C13溶液中加过量NaOH溶液 |
| B、向NaAlO2溶液中加过量盐酸 |
| C、向KOH溶液中加过量的Al2(S04)3溶液 |
| D、向BaCl2溶液中通人少量CO2 |
下列说法正确的是( )
A、将25℃纯水加热至95℃时,
| ||||
B、将pH=11的Na2CO3溶液加水稀释,
| ||||
| C、室温下,pH=a的盐酸与pH=b的氨水等体积混合后pH=7,则a+b=14 | ||||
| D、0.1mol?L-1酸HA与0.1mol?L-1NaOH溶液等体积混合后pH>7,则c(Na+)═c(A-)+c(HA)═0.1mol?L- |