题目内容
向恒容密闭容器中充入一定量 PCl5,在温度为T时发生反应PCl5(g)?PCl3(g)+Cl2(g)△H=+124kJ?mol-1.回答下列问题:
(1)要提高上述反应的转化率,可采取的措施有 .
(2)在热水中,五氯化磷完全水解,生成磷酸(H3PO4),该反应的化学方程式是 .若将0.01mol PCl5投入热水中,向其中滴加NaOH溶液至酸恰好被完全中和生成正盐,继续加水得到1L溶液,再逐滴加入AgNO3溶液,先产生的沉淀是 [已知Ksp(Ag3PO4)=1.4×10-16,Ksp(AgCl)=1.8×
10-10].
(3)已知白磷(P4)的燃烧热为3093.2kJ/mol,请写出白磷燃烧的热化学方程式 .
(1)要提高上述反应的转化率,可采取的措施有
(2)在热水中,五氯化磷完全水解,生成磷酸(H3PO4),该反应的化学方程式是
10-10].
(3)已知白磷(P4)的燃烧热为3093.2kJ/mol,请写出白磷燃烧的热化学方程式
考点:化学平衡的影响因素,热化学方程式
专题:基本概念与基本理论
分析:(1)反应PCl5(g)?PCl3(g)+Cl2(g)△H=+124kJ?mol-1是气体体积增大的吸热反应,要通过转化率,需使反应正向进行;
(2)根据五氯化磷完全水解,生成磷酸(H3PO4)写出反应的化学方程式;先计算出饱和磷酸银、氯化银沉淀需要银离子的浓度,需要银离子浓度越小,说明越难溶,加入银离子时优先生成沉淀;
(3)依据燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,标注物质聚集状态得到热化学方程式.
(2)根据五氯化磷完全水解,生成磷酸(H3PO4)写出反应的化学方程式;先计算出饱和磷酸银、氯化银沉淀需要银离子的浓度,需要银离子浓度越小,说明越难溶,加入银离子时优先生成沉淀;
(3)依据燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,标注物质聚集状态得到热化学方程式.
解答:
解:(1)反应PCl5(g)?PCl3(g)+Cl2(g)△H=+124kJ?mol-1是气体体积增大的吸热反应,要通过转化率,需使反应正向进行,可以升温、减压、移出部分生成物,
故答案为:升高温度(或降低压强或移走PCl3、Cl2等合理答案);
(2)在热水中,五氯化磷完全水解,生成磷酸(H3PO4),则该反应的化学方程式为:PCl5+4H2O=H3PO4+5HCl;
设饱和磷化银溶液中银离子浓度为x,则:Ksp(Ag3P04)=x3×(
)=1.4×10-16,x=
=
×10-4;设饱和氯化银溶液中银离子浓度为y,则y2=Ksp(AgCl)=1.8×10-10,y=
=
×10-5<
×10-4,所以0.01mol PCl5投入lL热水中,再逐滴加入AgN03溶液,先产生的沉淀是AgCl,
故答案为:PCl5+4H2O=H3PO4+5HCl;AgCl(或填名称“氯化银”);
(3)白磷(P4)的燃烧热为3093.2kJ/mol,依据燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,反应的热化学方程式为:P4(s)+5O2(g)=P4O10(s)△H=-3093.2 kJ/mol,
故答案为:P4(s)+5O2(g)=P4O10(s)△H=-3093.2 kJ/mol.
故答案为:升高温度(或降低压强或移走PCl3、Cl2等合理答案);
(2)在热水中,五氯化磷完全水解,生成磷酸(H3PO4),则该反应的化学方程式为:PCl5+4H2O=H3PO4+5HCl;
设饱和磷化银溶液中银离子浓度为x,则:Ksp(Ag3P04)=x3×(
| x |
| 3 |
| 4 | 4.2×10-16 |
| 4 | 4.2 |
| 1.8×10-10 |
| 1.8 |
| 4 | 4.2 |
故答案为:PCl5+4H2O=H3PO4+5HCl;AgCl(或填名称“氯化银”);
(3)白磷(P4)的燃烧热为3093.2kJ/mol,依据燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,反应的热化学方程式为:P4(s)+5O2(g)=P4O10(s)△H=-3093.2 kJ/mol,
故答案为:P4(s)+5O2(g)=P4O10(s)△H=-3093.2 kJ/mol.
点评:本题考查了化学平衡的移动、盐类水解、沉淀的转化、热化学方程式书写,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
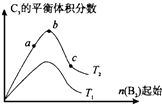 已知2A2(g)+B2(g)?2C3(g);△H=-Q1 kJ/mol(Q1>0),在一个有催化剂的固定容积的容器中加入2molA2和1molB2,在500℃时充分反应,达平衡后C3的浓度为w mol?L-1,放出热量为Q2 kJ.
已知2A2(g)+B2(g)?2C3(g);△H=-Q1 kJ/mol(Q1>0),在一个有催化剂的固定容积的容器中加入2molA2和1molB2,在500℃时充分反应,达平衡后C3的浓度为w mol?L-1,放出热量为Q2 kJ.