题目内容
已知A、B、C、D、E五种主族元素分属三个短周期,且原子序数依次增大.A、C同主族,可形成离子化合物CA;B、D同主族,可形成DB2、DB3两种分子.请回答下列问题:
(1)元素E在元素周期表中的位置是
(2)A、B两种元素能形成两种常温下呈液态的化合物M、N,具有强氧化性的化合物M的电子式可表示为 ;化合物N在同主族元素形成有具有相同结构的物质中,具有较高的沸点,其原因是 .
(3)A、B、C、D中的三种或四种元素能形成多种离子化合物,其水溶液呈碱性的有 (写出所有化合物,用化学式表示,下同),呈酸性的有 (写出所有化合物).
(4)元素B、E的单质或两元素之间形成的化合物可作水消毒剂的有 (写出其中两种物质的化学式).
(1)元素E在元素周期表中的位置是
(2)A、B两种元素能形成两种常温下呈液态的化合物M、N,具有强氧化性的化合物M的电子式可表示为
(3)A、B、C、D中的三种或四种元素能形成多种离子化合物,其水溶液呈碱性的有
(4)元素B、E的单质或两元素之间形成的化合物可作水消毒剂的有
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D、E五种主族元素分属三个短周期,且原子序数依次增大,所以A是H元素;A、C同主族,可形成离子化合物CA,且C原子序数B原子序数,所以C是Na元素;B、D同主族,可形成DB2、DB3两种分子,所以B是O元素,D是S元素,E是短周期主族元素,所以E是Cl元素,据此答题.
解答:
解:A、B、C、D、E五种主族元素分属三个短周期,且原子序数依次增大,所以A是H元素;A、C同主族,可形成离子化合物CA,且C原子序数B原子序数,所以C是Na元素;B、D同主族,可形成DB2、DB3两种分子,所以B是O元素,D是S元素,E是短周期主族元素,所以E是Cl元素.
(1)通过以上分析知,E是Cl元素,属于第三周期ⅦA族;
故答案为:第三周期ⅦA族;
(2)A、B两种元素能形成两种常温下呈液态的化合物有水和双氧水,双氧水具有强氧化性,所以具有强氧化性的化合物M是双氧水,双氧水的电子式可表示为 ;化合物N是水,在同主族元素形成有具有相同结构的物质中,水分子间形成氢键导致水具有较高的沸点.
;化合物N是水,在同主族元素形成有具有相同结构的物质中,水分子间形成氢键导致水具有较高的沸点.
故答案为: ;水分子间存在氢键;
;水分子间存在氢键;
(3)A、B、C、D中的三种或四种元素能形成多种离子化合物,其水溶液呈碱性的有NaOH、Na2SO3、NaHS,水溶液呈酸性的有NaHSO4、NaHSO3;能和盐酸发生氧化还原反应的是 Na2S2O3.
故答案为:NaOH、Na2SO3、NaHS;NaHSO4、NaHSO3;
(4)Y的单质O3、G的单质Cl2、二者形成的ClO2都可作消毒剂,故答案为:O3、Cl2、ClO2等.
(1)通过以上分析知,E是Cl元素,属于第三周期ⅦA族;
故答案为:第三周期ⅦA族;
(2)A、B两种元素能形成两种常温下呈液态的化合物有水和双氧水,双氧水具有强氧化性,所以具有强氧化性的化合物M是双氧水,双氧水的电子式可表示为
 ;化合物N是水,在同主族元素形成有具有相同结构的物质中,水分子间形成氢键导致水具有较高的沸点.
;化合物N是水,在同主族元素形成有具有相同结构的物质中,水分子间形成氢键导致水具有较高的沸点.故答案为:
 ;水分子间存在氢键;
;水分子间存在氢键;(3)A、B、C、D中的三种或四种元素能形成多种离子化合物,其水溶液呈碱性的有NaOH、Na2SO3、NaHS,水溶液呈酸性的有NaHSO4、NaHSO3;能和盐酸发生氧化还原反应的是 Na2S2O3.
故答案为:NaOH、Na2SO3、NaHS;NaHSO4、NaHSO3;
(4)Y的单质O3、G的单质Cl2、二者形成的ClO2都可作消毒剂,故答案为:O3、Cl2、ClO2等.
点评:本题主要考查了元素周期表、氢键、元素化合物知识等,中等难度,解题的关键是元素的推断,答题时注意元素化合物知识的灵活运用.

练习册系列答案
 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
常温下,下列三个反应均能发生:X2+2W2+═2X-+2W3+;Z2+2X-═2Z-+X2;2W3++2Y-═2W2++Y2.则在相同条件下,下列三个反应:①Y2+2X-═2Y-+X2;②Z2+2Y-═2Z-+Y2;③2W3++2Z-═2W2++Z2也能发生的是( )
| A、只有① | B、只有② |
| C、①和② | D、②和③ |
β-月桂烯的结构如图所示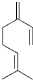 ,该物质与溴1:1发生加成反应的产物(不考虑顺反异构)理论上最多有( )
,该物质与溴1:1发生加成反应的产物(不考虑顺反异构)理论上最多有( )
 ,该物质与溴1:1发生加成反应的产物(不考虑顺反异构)理论上最多有( )
,该物质与溴1:1发生加成反应的产物(不考虑顺反异构)理论上最多有( )| A、3种 | B、4种 | C、5种 | D、6种 |
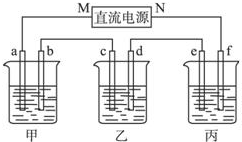 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题:
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题:
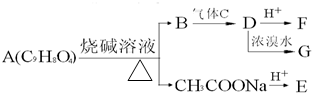 A为药用有机物,从A出发可发生如图所示的一系列反应.已知A在一定条件下能与醇发生酯化反应,A分子中的苯环上有两个取代基,且苯环上的一卤代物有两种,D不能与NaHCO3溶液反应,但能与NaOH溶液反应.请回答下列问题:
A为药用有机物,从A出发可发生如图所示的一系列反应.已知A在一定条件下能与醇发生酯化反应,A分子中的苯环上有两个取代基,且苯环上的一卤代物有两种,D不能与NaHCO3溶液反应,但能与NaOH溶液反应.请回答下列问题: