题目内容
现有A、B、C、D四种短周期元素,已知A、B同主族,B、C、D同周期,A、B的原子序数之和等于C、D的原子序数之和,C的单质能分别跟B和D的最高价氧化物的水化物反应.请回答:
(1)B和C'的元素符号分别为
(2)上述四种元素的原子半径由大到小的顺序为 (用元素符号表示);
(3)D单质在A单质中燃烧的产物与二氧化碳反应的化学方程式为
(4)B单质能跟D的最高价氧化物水化物的浓溶液发生氧化还原反应,生成的两种盐的水溶液均呈碱性,该氧化还原反应的离子方程式为 .
(1)B和C'的元素符号分别为
(2)上述四种元素的原子半径由大到小的顺序为
(3)D单质在A单质中燃烧的产物与二氧化碳反应的化学方程式为
(4)B单质能跟D的最高价氧化物水化物的浓溶液发生氧化还原反应,生成的两种盐的水溶液均呈碱性,该氧化还原反应的离子方程式为
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D四种短周期元素,B、C、D同周期,且C的单质能分别跟B和D的最高价氧化物的水化物反应,可知C是Al,B、D的最高价氧化物的水化物应该为强酸、强碱;根据(3)“D单质在A单质中燃烧的产物与二氧化碳反应”可知D为Na、A是O,又因A、B同主族,所以B为S;O、S的原子序数之和为24,Al、Na的原子序数之和也为24,两者相等,故可以确定:A为O元素、B为S元素、C为Al、D为Na,
然后结合对应的化合物的性质以及元素周期律的递变规律解答该题.
然后结合对应的化合物的性质以及元素周期律的递变规律解答该题.
解答:
解:(1)A、B、C、D四种短周期元素,B、C、D同周期,且C的单质能分别跟B和D的最高价氧化物的水化物反应,可知C是Al,B、D的最高价氧化物的水化物应该为强酸、强碱;根据(3)“D单质在A单质中燃烧的产物与二氧化碳反应”可知D为Na、A是O,又因A、B同主族,所以B为S;O、S的原子序数之和为24,Al、Na的原子序数之和也为24,两者相等,故可以确定:A为O元素、B为S元素、C为Al、D为Na,
故答案为:S、Al;
(2)Na、Al、S位于同一周期,随着原子序数的增大半径逐渐减小,则原子半径大小为:Na>Al>S,O和S位于同一主族,原子序数越大,半径越大,则有S>O,则四种元素的原子半径大小为:Na>Al>S>O,
故答案为:Na>Al>S>O;
(3)D单质在A单质中燃烧的产物为Na2O2,与CO2反应生成Na2CO3和O2,反应的化学方程式为:2Na2O2+2CO2═2Na2CO3+O2,
故答案为:2Na2O2+2CO2═2Na2CO3+O2;
(4)B为S元素,D为Na元素,钠的最高价氧化物对应的水化物为NaOH,单质硫与浓NaOH溶液反应,生成两种盐的水溶液显碱性,说明生成的盐是弱酸强碱盐,硫元素形成的弱酸有氢硫酸和亚硫酸,考虑到反应为氧化还原反应,则可确定生成Na2S和Na2SO3,反应的化学方程式为:3S+6NaOH=2Na2S+Na2SO3+3H2O,改为离子方程式:3S+6OH-=2S2-+SO32-+H2O,
故答案为:3S+6OH-=2S2-+SO32-+H2O.
故答案为:S、Al;
(2)Na、Al、S位于同一周期,随着原子序数的增大半径逐渐减小,则原子半径大小为:Na>Al>S,O和S位于同一主族,原子序数越大,半径越大,则有S>O,则四种元素的原子半径大小为:Na>Al>S>O,
故答案为:Na>Al>S>O;
(3)D单质在A单质中燃烧的产物为Na2O2,与CO2反应生成Na2CO3和O2,反应的化学方程式为:2Na2O2+2CO2═2Na2CO3+O2,
故答案为:2Na2O2+2CO2═2Na2CO3+O2;
(4)B为S元素,D为Na元素,钠的最高价氧化物对应的水化物为NaOH,单质硫与浓NaOH溶液反应,生成两种盐的水溶液显碱性,说明生成的盐是弱酸强碱盐,硫元素形成的弱酸有氢硫酸和亚硫酸,考虑到反应为氧化还原反应,则可确定生成Na2S和Na2SO3,反应的化学方程式为:3S+6NaOH=2Na2S+Na2SO3+3H2O,改为离子方程式:3S+6OH-=2S2-+SO32-+H2O,
故答案为:3S+6OH-=2S2-+SO32-+H2O.
点评:本题考查元素周期表中位置、结构、性质的关系及应用及信息型化学方程式的书写,题目难度中等,本题侧重于物质的性质的考查,注意把握两性氢氧化物的性质以及相关方程式的书写.

练习册系列答案
相关题目
下列叙述正确的是( )
| A、足量的硫单质与64g铜反应,有2mol电子发生转移 |
| B、常温下,向AgCl悬浊液中加入少量NaCl固体后振荡,Kap(AgCl)增大 |
| C、0.1mol?L-1Na2CO3中加入少量NaOH固体振荡,c(Na+)和c(CO32-)都增大 |
| D、相同浓度的CH2COOH和CH2COONa溶液等体积混合后,则:c(CH2COO-)+c(CH2COOH)=c(Na+) |
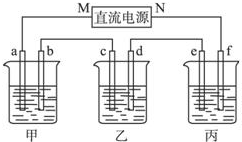 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题:
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题: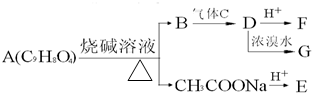 A为药用有机物,从A出发可发生如图所示的一系列反应.已知A在一定条件下能与醇发生酯化反应,A分子中的苯环上有两个取代基,且苯环上的一卤代物有两种,D不能与NaHCO3溶液反应,但能与NaOH溶液反应.请回答下列问题:
A为药用有机物,从A出发可发生如图所示的一系列反应.已知A在一定条件下能与醇发生酯化反应,A分子中的苯环上有两个取代基,且苯环上的一卤代物有两种,D不能与NaHCO3溶液反应,但能与NaOH溶液反应.请回答下列问题: