题目内容
X、Y、Z、L、M五种元素的原子序数依次增大.X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素.回答下列问题:
(1)L的元素符号为 ;M在元素周期表中的位置为 ;五种元素的原子半径从大到小的顺序是 (用元素符号表示),画出Z的原子结构示意图:
(2)Z、X两元素按原子数目比l:3构成分子A,A的电子式为 .
(3)在常温、101kPa时,1.00mol X的单质在足量O2中完全燃烧生成液态氧化物时,放出285.8kJ的热量,则表示X单质的燃烧热的热化学方程式为 ,若充分燃烧10克的X可放出 KJ的热量.
(1)L的元素符号为
(2)Z、X两元素按原子数目比l:3构成分子A,A的电子式为
(3)在常温、101kPa时,1.00mol X的单质在足量O2中完全燃烧生成液态氧化物时,放出285.8kJ的热量,则表示X单质的燃烧热的热化学方程式为
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:M是地壳中含量最高的金属元素,所以M是Al,X、Y、Z、L是组成蛋白质的基础元素,且X、Y、Z、L、M五种元素的原子序数依次增大,所以X、Y、Z、L分别是H、C、N、O,据此答题.
解答:
解:M是地壳中含量最高的金属元素,所以M是Al,X、Y、Z、L是组成蛋白质的基础元素,且X、Y、Z、L、M五种元素的原子序数依次增大,所以X、Y、Z、L分别是H、C、N、O.
(1)L的元素符号为O,Al位于周期表中第3周期第ⅢA族,电子层越多半径越大,所以金属铝的半径最大,H的半径最小,同周期元素的原子从左到右半径逐渐减小,所以C>N>O,故原子半径大小顺序为:Al>C>N>O>H,Z为氮元素,原子结构示意图为 ,
,
故答案为:O;第3周期第ⅢA族; Al>C>N>O>H; ;
;
(2)N和H两元素按原子数目比l:3构成分子NH3,氨气的电子式为: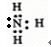 ,故答案为:
,故答案为: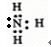 ;
;
(3)在常温、101kPa时,1.00mol H2在足量O2中完全燃烧生成液态水时,放出285.8kJ的热量,则表示H2的燃烧热的热化学方程式为H2(g)+
O2(g)═H2O(l)△H=-285.8kJ?mol-1,若充分燃烧10克(即5mol)的 H2可放出的热量为5×285.8KJ=1429KJ,
故答案为:H2(g)+
O2(g)═H2O(l)△H=-285.8kJ?mol-1;1429.
(1)L的元素符号为O,Al位于周期表中第3周期第ⅢA族,电子层越多半径越大,所以金属铝的半径最大,H的半径最小,同周期元素的原子从左到右半径逐渐减小,所以C>N>O,故原子半径大小顺序为:Al>C>N>O>H,Z为氮元素,原子结构示意图为
 ,
,故答案为:O;第3周期第ⅢA族; Al>C>N>O>H;
 ;
;(2)N和H两元素按原子数目比l:3构成分子NH3,氨气的电子式为:
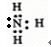 ,故答案为:
,故答案为: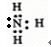 ;
;(3)在常温、101kPa时,1.00mol H2在足量O2中完全燃烧生成液态水时,放出285.8kJ的热量,则表示H2的燃烧热的热化学方程式为H2(g)+
| 1 |
| 2 |
故答案为:H2(g)+
| 1 |
| 2 |
点评:本题主要考查了元素周期律和元素周期表、电子式、热化学方程式等知识,中等难度,元素推断是解题的关键,答题时注意反应热的计算及燃烧热的定义的应用.

练习册系列答案
相关题目
设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A、常温常压下,8gO2含有4NA个电子 |
| B、1L 1mol/L 的NaClO 溶液中含有ClO-的数目为NA |
| C、标准状况下,22.4L盐酸含有NA个HCl分子 |
| D、1mol Na被完全氧化生成Na2O2,失去2NA个电子 |
按下列实验方法能达到要求的是( )
| A、用分液漏斗分离醋酸和水的混合物 |
| B、用酒精萃取碘水中的碘 |
| C、用10mL量筒量取7.5mL稀盐酸 |
| D、用容量瓶配置溶液过程中定容时发现蒸馏水稍微过量,可用胶头滴管吸出少许 |

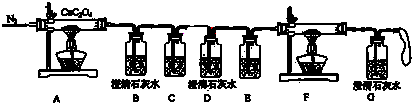
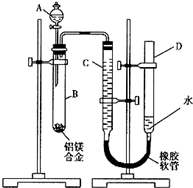 含镁3%-5%的镁铝合金,现已成为轮船制造、化工生产、机械制造等行业的重要原材料.现有一块已知质量为m1g的镁铝合金,欲测定其中镁的质量分数,几位同学设计了以下三种不同的实验方案:
含镁3%-5%的镁铝合金,现已成为轮船制造、化工生产、机械制造等行业的重要原材料.现有一块已知质量为m1g的镁铝合金,欲测定其中镁的质量分数,几位同学设计了以下三种不同的实验方案: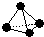 ,已知断裂1mol B-B键吸收167kJ的热量,生成1mol B≡B键放出942kJ热量.试判断相同条件下B4与B2的稳定性顺序是:
,已知断裂1mol B-B键吸收167kJ的热量,生成1mol B≡B键放出942kJ热量.试判断相同条件下B4与B2的稳定性顺序是: