题目内容
X、Y、Z、W是元素周期表前四周期中的常见元素,其相关信息如下表:
(1)W位于元素周期表第 周期第 族,其基态原子最外层有 个电子.
(2)X元素基态原子的价电子的电子排布图为 ;X的电负性比Y的 (填“大”或“小”);X和Y的气态氢化物中,较稳定的是 (写化学式)
| 元素 | 相关信息 |
| X | X的基态原子L层电子数是K层电子数的2倍 |
| Y | Y的基态原子最外层电子排布式为:nsnnpn+2 |
| Z | Z存在质量数为23,中子数为12的核素 |
| W | W有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
(2)X元素基态原子的价电子的电子排布图为
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:X的基态原子L层电子数是K层电子数的2倍,则X为C元素;Y的基态原子最外层电子排布式为nsnnpn+2,是能级只能容纳2个电子,则n=2,故Y为O元素;Z存在质量数为23,中子数为12的核素,则其质子数为23-12=11,则Z为Na;W有多种化合价,其白色氢氧化合物在空气中会迅速变成灰绿色,最后变成红褐色,则W为Fe,据此解答.
解答:
解:X的基态原子L层电子数是K层电子数的2倍,则X为C元素;Y的基态原子最外层电子排布式为nsnnpn+2,是能级只能容纳2个电子,则n=2,故Y为O元素;Z存在质量数为23,中子数为12的核素,则其质子数为23-12=11,则Z为Na;W有多种化合价,其白色氢氧化合物在空气中会迅速变成灰绿色,最后变成红褐色,则W为Fe,
(1)W为Fe,位于元素周期表第四周期,其基态原子的价电排布式为3d64s2,所以其基态原子最外层有2个电子,故答案为:四;Ⅷ;2;
(2)X为碳元素,基态原子的价电子的电子排布图为 ,根据元素周期律,碳的电负性比氧的小;由于氧的非金属性强于碳,所以水的稳定性强于甲烷,故答案为:
,根据元素周期律,碳的电负性比氧的小;由于氧的非金属性强于碳,所以水的稳定性强于甲烷,故答案为: ;小;H2O.
;小;H2O.
(1)W为Fe,位于元素周期表第四周期,其基态原子的价电排布式为3d64s2,所以其基态原子最外层有2个电子,故答案为:四;Ⅷ;2;
(2)X为碳元素,基态原子的价电子的电子排布图为
 ,根据元素周期律,碳的电负性比氧的小;由于氧的非金属性强于碳,所以水的稳定性强于甲烷,故答案为:
,根据元素周期律,碳的电负性比氧的小;由于氧的非金属性强于碳,所以水的稳定性强于甲烷,故答案为: ;小;H2O.
;小;H2O.
点评:本题主要考查了元素周期表、元素周期律、电子排布图等知识,难度不大,解题的关键是元素的推断,答题时注意仔细审题,按题中要求答题.

练习册系列答案
相关题目
β-月桂烯的结构如图所示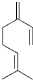 ,该物质与溴1:1发生加成反应的产物(不考虑顺反异构)理论上最多有( )
,该物质与溴1:1发生加成反应的产物(不考虑顺反异构)理论上最多有( )
 ,该物质与溴1:1发生加成反应的产物(不考虑顺反异构)理论上最多有( )
,该物质与溴1:1发生加成反应的产物(不考虑顺反异构)理论上最多有( )| A、3种 | B、4种 | C、5种 | D、6种 |
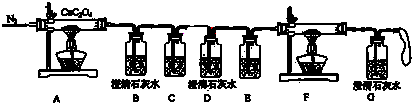
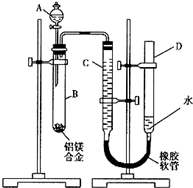 含镁3%-5%的镁铝合金,现已成为轮船制造、化工生产、机械制造等行业的重要原材料.现有一块已知质量为m1g的镁铝合金,欲测定其中镁的质量分数,几位同学设计了以下三种不同的实验方案:
含镁3%-5%的镁铝合金,现已成为轮船制造、化工生产、机械制造等行业的重要原材料.现有一块已知质量为m1g的镁铝合金,欲测定其中镁的质量分数,几位同学设计了以下三种不同的实验方案: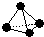 ,已知断裂1mol B-B键吸收167kJ的热量,生成1mol B≡B键放出942kJ热量.试判断相同条件下B4与B2的稳定性顺序是:
,已知断裂1mol B-B键吸收167kJ的热量,生成1mol B≡B键放出942kJ热量.试判断相同条件下B4与B2的稳定性顺序是: