题目内容
技术的发展与创新永无止境,我国化学家侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如图:
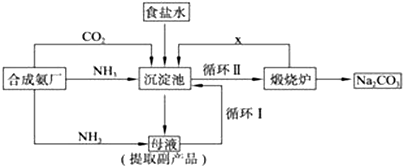
(1)向沉淀池中要通入CO2和氨气,应先通入 (填化学式).原因是 .
(2)沉淀池中发生反应的化学方程式是 .
(3)母液中的溶质主要有 .
(4)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了 (填上述流程中的编号)的循环,物质X是 .

(1)向沉淀池中要通入CO2和氨气,应先通入
(2)沉淀池中发生反应的化学方程式是
(3)母液中的溶质主要有
(4)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了
考点:纯碱工业(侯氏制碱法)
专题:化学应用
分析:(1)氨气极易溶于水,二氧化碳在水中的溶解度较小;
(2)饱和食盐水中通入氨气和二氧化碳析出碳酸氢钠晶体;
(3)根据反应方程式确定母液中的溶质;
(4)循环Ⅰ中的氯化钠有又返回到沉淀池;
(2)饱和食盐水中通入氨气和二氧化碳析出碳酸氢钠晶体;
(3)根据反应方程式确定母液中的溶质;
(4)循环Ⅰ中的氯化钠有又返回到沉淀池;
解答:
解:(1)二氧化碳在水中的溶解度较小,氨气极易溶于水,所以应该先通氨气有利于吸收二氧化碳,
故答案为:NH3;CO2在NaCl溶液中的溶解度较小,而NH3极易溶于水;
(2)氨气、二氧化碳、水和氯化钠发生反应生成碳酸氢钠和氯化铵,反应方程式为NH3+H2O+CO2+NaCl═NH4Cl+NaHCO3↓,
故答案为:NH3+H2O+CO2+NaCl═NH4Cl+NaHCO3↓;
(3)根据NH3+H2O+CO2+NaCl═NH4Cl+NaHCO3↓及流程图知,母液中溶质为氯化铵,
故答案为:NH4Cl;
(4)循环Ⅰ是将未反应的氯化钠返回沉淀池中,煅烧碳酸氢钠时生成二氧化碳、二氧化碳能循环利用,所以X是CO2,
故答案为:循环Ⅰ;CO2;
故答案为:NH3;CO2在NaCl溶液中的溶解度较小,而NH3极易溶于水;
(2)氨气、二氧化碳、水和氯化钠发生反应生成碳酸氢钠和氯化铵,反应方程式为NH3+H2O+CO2+NaCl═NH4Cl+NaHCO3↓,
故答案为:NH3+H2O+CO2+NaCl═NH4Cl+NaHCO3↓;
(3)根据NH3+H2O+CO2+NaCl═NH4Cl+NaHCO3↓及流程图知,母液中溶质为氯化铵,
故答案为:NH4Cl;
(4)循环Ⅰ是将未反应的氯化钠返回沉淀池中,煅烧碳酸氢钠时生成二氧化碳、二氧化碳能循环利用,所以X是CO2,
故答案为:循环Ⅰ;CO2;
点评:本题考查了实验方案的设计,明确物质的性质是解本题关键,了解制备原理,知道常见物质分离的方法,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
最近上市的苹果NeW采用了新型锂离子电池,该电池以Li2FeSiO4、嵌有Li的石墨为电极,含Li+的导电固体为电解质,充、放电的总反应式可表示为Li2FeSiO4
Li+LiFeSiO4,下列说法中不正确的是( )
| 充电 |
| 放电 |
| A、放电时,电池是将化学能转化为电能 |
| B、放电时,正极反应式:LiFeSiO4+Li++e-═Li2SiO4 |
| C、充电时,毎生成1molLiFeSiO4转移2mol电子 |
| D、充电时,Li+向阴极移动 |
设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A、常温常压下,8gO2含有4NA个电子 |
| B、1L 1mol/L 的NaClO 溶液中含有ClO-的数目为NA |
| C、标准状况下,22.4L盐酸含有NA个HCl分子 |
| D、1mol Na被完全氧化生成Na2O2,失去2NA个电子 |
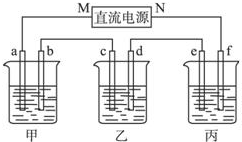 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题:
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题:
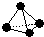 ,已知断裂1mol B-B键吸收167kJ的热量,生成1mol B≡B键放出942kJ热量.试判断相同条件下B4与B2的稳定性顺序是:
,已知断裂1mol B-B键吸收167kJ的热量,生成1mol B≡B键放出942kJ热量.试判断相同条件下B4与B2的稳定性顺序是: