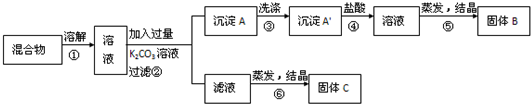
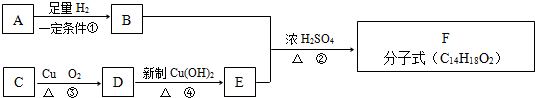
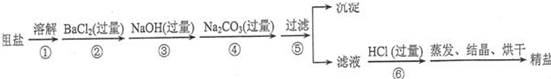
题目内容
根据下表下列叙述正确的是( )
| 序号 | 氧化剂 | 还原剂 | 其它反应物 | 氧化产物 | 还原产物 |
| ① | Cl2 | FeBr2 | FeCl3 | ||
| ② | KMnO4 | H2O2 | H2SO4 | O2 | MnSO4 |
| ③ | KClO3 | HCl(浓) | Cl2 | Cl2 | |
| ④ | KMnO4 | HCl(浓) | Cl2 | MnCl2 |
| A、表中第①组反应的氧化产物中一定有FeCl3 |
| B、氧化性比较:KMnO4>Cl2>Fe3+>Br2>Fe2+ |
| C、还原性比较:H2O2>Mn2+>Cl- |
| D、④的离子方程式配平后,H+的化学计量数为16 |
考点:氧化性、还原性强弱的比较,氧化还原反应
专题:
分析:A.氯气和溴化亚铁反应时,先氧化铁离子、后氧化溴离子;
B.自发进行的氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性;
C.自发进行的氧化还原反应中,还原剂的还原性大于还原产物的还原性;
D.氧化还原反应根据转移电子配平方程式,据此分析解答.
B.自发进行的氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性;
C.自发进行的氧化还原反应中,还原剂的还原性大于还原产物的还原性;
D.氧化还原反应根据转移电子配平方程式,据此分析解答.
解答:
解:A.氯气和溴化亚铁反应时先氧化亚铁离子后氧化溴离子,所以表中第①组反应的氧化产物中一定有FeCl3,故A正确;
B.根据①知,氧化性Cl2>Fe3+,根据②知,氧化性KMnO4>O2,根据③知氧化性KClO3>Cl2,根据④知氧化性KMnO4>Cl2,根据以上分析无法判断Br2、Fe2+氧化性相对大小,故B错误;
C.根据②知还原性H2O2>Mn2+,根据③知氧化性Mn2+<Cl-,故C错误;
D.该反应中Mn元素化合价由+7价变为+2价、Cl元素化合价由-1价变为0价,其转移电子数为10,方程式为2KMnO4+12HCl(浓)=5Cl2+2MnCl2+6H2O,所以H+的化学计量数为16,故D正确;
故选AD.
B.根据①知,氧化性Cl2>Fe3+,根据②知,氧化性KMnO4>O2,根据③知氧化性KClO3>Cl2,根据④知氧化性KMnO4>Cl2,根据以上分析无法判断Br2、Fe2+氧化性相对大小,故B错误;
C.根据②知还原性H2O2>Mn2+,根据③知氧化性Mn2+<Cl-,故C错误;
D.该反应中Mn元素化合价由+7价变为+2价、Cl元素化合价由-1价变为0价,其转移电子数为10,方程式为2KMnO4+12HCl(浓)=5Cl2+2MnCl2+6H2O,所以H+的化学计量数为16,故D正确;
故选AD.
点评:本题考查氧化还原反应,明确氧化性、还原性强弱比较方法是解本题关键,会根据电子转移相等配平方程式,题目难度不大.

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目
下列离子方程式书写正确的是( )
| A、硝酸银溶液和氯化钠溶液反应:Ag++Cl-=AgCl↓ |
| B、铁和稀盐酸反应 2Fe+6H+=2Fe3++3H2↑ |
| C、石灰石与盐酸反应:CO32-+2H+=H2O+CO2↑ |
| D、硫酸铜溶液和氢氧化钡溶液反应:2OH-+Cu2+=Cu(OH)2↓ |
在25℃时,某溶液中由水电离出的c(H+)=1.0×10-12mol/L,则该溶液中可能大量共存的离子是( )
| A、Na+、OH-、S2-、NO3- |
| B、AlO2-、K+、Fe3+、Na+ |
| C、Al3+、Cl-、HCO3-、Na+ |
| D、Fe2+、K+、Cl-、NO3- |
下列各组物质,属于电解质是( )
| A、NaCl晶体 | B、铜 |
| C、酒精 | D、硫酸溶液 |
 .已知:
.已知: