题目内容
现有A、B、C、D、E、F六种短周期元素,在化学反应中均能形成简单的阴离子或阳离子,且A、B、C、D离子具有相同的电子层结构.B是一种金属元素,其余为非金属元素.已知:
①常温下,F的单质是一种有色气体,常用于杀菌、消毒;
②A的氧化物既能溶于NaOH溶液,又能溶于盐酸;
③C的氢化物分子G是具有10电子的微粒,且可以发生下列转化:
G
P
Q
P
④E和D是同主族元素,氢化物(H2E)常温下为气态.
⑤B和D可形成微粒个数比为1:1和2:1的离子化合物X和Y.
请回答下列问题:
(1)F元素在的原子结构示意图 ;G为 化合物(填“离子”或“共价”).
(2)请写出G的结构式 ;X的电子式 .
(3)E的非金属性比F (填“强”或“弱”),并用化学事实加以说明(用化学方程式表示) .
(4)写出C、D、E的氢化物的沸点从大到小的顺序是 .
(5)请用电子式表示E的氢化物的形成过程 .
(6)工业上制备A单质的反应原理 .
①常温下,F的单质是一种有色气体,常用于杀菌、消毒;
②A的氧化物既能溶于NaOH溶液,又能溶于盐酸;
③C的氢化物分子G是具有10电子的微粒,且可以发生下列转化:
G
| D的单质 |
| D的单质 |
| H2O |
④E和D是同主族元素,氢化物(H2E)常温下为气态.
⑤B和D可形成微粒个数比为1:1和2:1的离子化合物X和Y.
请回答下列问题:
(1)F元素在的原子结构示意图
(2)请写出G的结构式
(3)E的非金属性比F
(4)写出C、D、E的氢化物的沸点从大到小的顺序是
(5)请用电子式表示E的氢化物的形成过程
(6)工业上制备A单质的反应原理
考点:位置结构性质的相互关系应用,电子式
专题:元素周期律与元素周期表专题
分析:现有A、B、C、D、E、F六种短周期元素,在化学反应中均能形成简单的阴离子或阳离子,且A、B、C、D离子具有相同的电子层结构,①常温下,F的单质是一种有色气体,常用于杀菌、消毒,则F是Cl元素;
②A的氧化物既能溶于NaOH溶液,又能溶于盐酸,则A是Al元素;
③C的氢化物分子G是具有10电子的微粒,且可以发生下列转化:G
P
Q
P,则C是N元素,O为O,G为NH3,P为NO;
④E和D是同主族元素,氢化物(H2E)常温下为气态,则E是S元素,D是O元素;
⑤B和D可形成微粒个数比为1:1和2:1的离子化合物X和Y,则B是Na元素,以此来解答.
②A的氧化物既能溶于NaOH溶液,又能溶于盐酸,则A是Al元素;
③C的氢化物分子G是具有10电子的微粒,且可以发生下列转化:G
| D的单质 |
| D的单质 |
| H2O |
④E和D是同主族元素,氢化物(H2E)常温下为气态,则E是S元素,D是O元素;
⑤B和D可形成微粒个数比为1:1和2:1的离子化合物X和Y,则B是Na元素,以此来解答.
解答:
解:现有A、B、C、D、E、F六种短周期元素,在化学反应中均能形成简单的阴离子或阳离子,且A、B、C、D离子具有相同的电子层结构,
①常温下,F的单质是一种有色气体,常用于杀菌、消毒,则F是Cl元素;
②A的氧化物既能溶于NaOH溶液,又能溶于盐酸,则A是Al元素;
③C的氢化物分子G是具有10电子的微粒,且可以发生下列转化:G
P
Q
P,则C是N元素,O为O,G为NH3,P为NO;
④E和D是同主族元素,氢化物(H2E)常温下为气态,则E是S元素,D是O元素;
⑤B和D可形成微粒个数比为1:1和2:1的离子化合物X和Y,则B是Na元素,
(1)F元素为Cl,其原子结构示意图为 ,G为NH3,只含N-H共价键,为共价化合物,故答案为:
,G为NH3,只含N-H共价键,为共价化合物,故答案为: ;共价;
;共价;
(2)G为NH3,结构式为 ,X是过氧化钠,过氧化钠中钠离子和过氧根离子之间存在离子键,氧原子和氧原子之间存在共价键,其电子式为
,X是过氧化钠,过氧化钠中钠离子和过氧根离子之间存在离子键,氧原子和氧原子之间存在共价键,其电子式为 ,故答案为:
,故答案为: ;
; ;
;
(3)同一周期中,元素的非金属性随着原子序数的增大而增强,硫和氯元素处于同一周期,且氯元素的原子序数大于硫元素,所以硫的非金属性比氯元素弱,氯气和硫化氢能发生置换反应,反应方程式为:H2S+Cl2=S+2HCl(其他合理答案也可),
故答案为:弱;H2S+Cl2=S+2HCl(其他合理答案H2+Cl2
2HCl、H2+S
H2S或2Fe+3Cl2
FeCl3或Fe+S
FeS)也可);
(4)O、N的氢化物含氢键沸点高,水中氢键的多于氨气中氢键,水中氢键作用力,则C、D、E的氢化物的沸点从大到小的顺序是H2O>NH3>H2S,
故答案为:H2O>NH3>H2S;
(5)E为S,氢化物硫化氢为共价化合物,其形成过程为 ,故答案为:
,故答案为: ;
;
(6)A为Al,为活泼金属,则工业上制备A单质的反应原理2Al2O3(熔融)
4Al+3O2↑,故答案为:2Al2O3(熔融)
4Al+3O2↑.
①常温下,F的单质是一种有色气体,常用于杀菌、消毒,则F是Cl元素;
②A的氧化物既能溶于NaOH溶液,又能溶于盐酸,则A是Al元素;
③C的氢化物分子G是具有10电子的微粒,且可以发生下列转化:G
| D的单质 |
| D的单质 |
| H2O |
④E和D是同主族元素,氢化物(H2E)常温下为气态,则E是S元素,D是O元素;
⑤B和D可形成微粒个数比为1:1和2:1的离子化合物X和Y,则B是Na元素,
(1)F元素为Cl,其原子结构示意图为
 ,G为NH3,只含N-H共价键,为共价化合物,故答案为:
,G为NH3,只含N-H共价键,为共价化合物,故答案为: ;共价;
;共价;(2)G为NH3,结构式为
 ,X是过氧化钠,过氧化钠中钠离子和过氧根离子之间存在离子键,氧原子和氧原子之间存在共价键,其电子式为
,X是过氧化钠,过氧化钠中钠离子和过氧根离子之间存在离子键,氧原子和氧原子之间存在共价键,其电子式为 ,故答案为:
,故答案为: ;
; ;
;(3)同一周期中,元素的非金属性随着原子序数的增大而增强,硫和氯元素处于同一周期,且氯元素的原子序数大于硫元素,所以硫的非金属性比氯元素弱,氯气和硫化氢能发生置换反应,反应方程式为:H2S+Cl2=S+2HCl(其他合理答案也可),
故答案为:弱;H2S+Cl2=S+2HCl(其他合理答案H2+Cl2
| ||
| ||
| ||
| ||
(4)O、N的氢化物含氢键沸点高,水中氢键的多于氨气中氢键,水中氢键作用力,则C、D、E的氢化物的沸点从大到小的顺序是H2O>NH3>H2S,
故答案为:H2O>NH3>H2S;
(5)E为S,氢化物硫化氢为共价化合物,其形成过程为
 ,故答案为:
,故答案为: ;
;(6)A为Al,为活泼金属,则工业上制备A单质的反应原理2Al2O3(熔融)
| ||
| ||
点评:本题考查位置、结构与性质的关系及应用,为高频考点,元素的推断为解答的关键,注意元素化合物知识在推断中的应用,侧重分析与推断能力的考查,题目难度中等.

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案
相关题目
下列关于氧化物的叙述正确的是( )
| A、金属氧化物一定是碱性氧化物,非金属氧化物一定是酸性氧化物 |
| B、酸性氧化物都能与水化合生成酸 |
| C、碱性氧化物都能与水化合生成碱 |
| D、碱性氧化物一定是金属氧化物,酸性氧化物不一定是非金属氧化物 |
某温度下,在一容积固定的容器中,反应aA(g)+bB(g)═hH(g)达到平衡后,A、B、H的物质的量分别为a mol、b mol和h mol.已知a+b=2h,若保持温度不变,将三者的物质的量增大一倍,则下列判断正确的是( )
| A、平衡不移动 |
| B、混合气体的密度不变 |
| C、B的体积分数增大 |
| D、a mol/L<c(A)<2a mol/L |
根据下表下列叙述正确的是( )
| 序号 | 氧化剂 | 还原剂 | 其它反应物 | 氧化产物 | 还原产物 |
| ① | Cl2 | FeBr2 | FeCl3 | ||
| ② | KMnO4 | H2O2 | H2SO4 | O2 | MnSO4 |
| ③ | KClO3 | HCl(浓) | Cl2 | Cl2 | |
| ④ | KMnO4 | HCl(浓) | Cl2 | MnCl2 |
| A、表中第①组反应的氧化产物中一定有FeCl3 |
| B、氧化性比较:KMnO4>Cl2>Fe3+>Br2>Fe2+ |
| C、还原性比较:H2O2>Mn2+>Cl- |
| D、④的离子方程式配平后,H+的化学计量数为16 |
下列有关描述中,与事实相符的是( )
| A、Al(OH)3、CaCO3都难溶,但溶解的部分都能完全电离 |
| B、复盐是纯净物,而混盐(如CaOCl2)是混合物 |
| C、弱电解质溶液中有溶质分子,但强电解质溶液中难以存在溶质分子 |
| D、电解质溶液能够导电,是因为通电使电解质电离产生了自由移动的离子 |
体积相同的盐酸和醋酸两溶液中n(Cl-)=n(CH3COO-)=0.01mol,下列正确的是( )
| A、两种溶液的pH不相同 |
| B、它们与NaOH完全中和时,醋酸溶液所消耗的NaOH多 |
| C、分别用水稀释相同倍数时,n(Cl-)=n(CH3COO-) |
| D、它们分别与足量CaCO3反应时,放出的CO2一样多 |
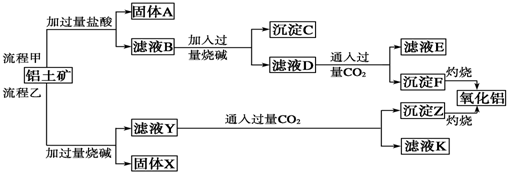
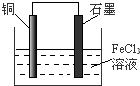
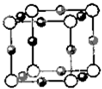 已知:A、B、C、D、E、F五种元素核电荷数依次增大,属周期表中前四周期的元素.其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中是最高的;F原子核外最外层电子数与B相同,其余各层均充满.请根据以上信息,回答下列问题:
已知:A、B、C、D、E、F五种元素核电荷数依次增大,属周期表中前四周期的元素.其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中是最高的;F原子核外最外层电子数与B相同,其余各层均充满.请根据以上信息,回答下列问题: