题目内容
Ⅰ、镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的.主要步骤如下:

(1)为了使MgSO4转化为Mg(OH)2,试剂①可以选用 ,要使MgSO4完全转化为沉淀,加入试剂的量应为 .
(2)加入试剂①后,能够分离得到Mg(OH)2沉淀的方法是 .
(3)试剂②选用 ;写出其反应的离子方程式 .
(4)无水MgCl2在熔融状态下,通电后产生镁和氯气,该反应的化学方程式
为 .
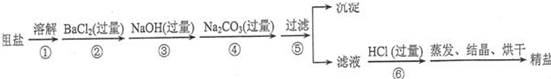
Ⅱ、某粗盐主要成分为氯化钠,杂质为不溶性泥沙和可溶性的MgCl2、CaCl2和Na2SO4.某校化学兴趣小组欲探究食盐的精制过程,以该粗盐为原料,设计方案流程如下:
试回答下列问题:
(1)在第①步和第⑤步中都要用到玻璃棒,它们的主要作用分别是 、
(2)第②步操作的目的是除去粗盐中的 (填化学式,下同),第⑥步操作的目的是除去滤液中的 、 .
(3)第⑤步“过滤”操作中得到沉淀的成分有:泥沙、BaSO4、Mg(OH)2、 、 (填化学式,下同).
(4)在第⑨步操作中,选择的除杂试剂不能用KOH代替NaOH,理由是 .
(5)写出第⑥步涉及的两个化学反应的离子方程式: 、 .

(1)为了使MgSO4转化为Mg(OH)2,试剂①可以选用
(2)加入试剂①后,能够分离得到Mg(OH)2沉淀的方法是
(3)试剂②选用
(4)无水MgCl2在熔融状态下,通电后产生镁和氯气,该反应的化学方程式
为
Ⅱ、某粗盐主要成分为氯化钠,杂质为不溶性泥沙和可溶性的MgCl2、CaCl2和Na2SO4.某校化学兴趣小组欲探究食盐的精制过程,以该粗盐为原料,设计方案流程如下:

试回答下列问题:
(1)在第①步和第⑤步中都要用到玻璃棒,它们的主要作用分别是
(2)第②步操作的目的是除去粗盐中的
(3)第⑤步“过滤”操作中得到沉淀的成分有:泥沙、BaSO4、Mg(OH)2、
(4)在第⑨步操作中,选择的除杂试剂不能用KOH代替NaOH,理由是
(5)写出第⑥步涉及的两个化学反应的离子方程式:
考点:物质分离和提纯的方法和基本操作综合应用,海水资源及其综合利用,粗盐提纯
专题:实验设计题
分析:Ⅰ、海水中加入氢氧化钠,将硫酸镁转化成氢氧化镁,氢氧化镁与盐酸反应生成氯化镁,通入蒸发浓缩、洗涤干燥得到干燥的氯化镁,然后电解熔融氯化镁获得金属镁,
(1)为了使MgSO4转化为Mg(OH)2,则加入的物质含有氢氧根离子且不阴极新的杂质离子,要使MgSO4完全转化为沉淀,加入试剂的量应为过量;
(2)分离不溶性固体和溶液的方法是过滤;
(3)盐酸和氢氧化镁反应生成氯化镁;
(4)电解熔融氯化镁生成氯气和镁;
Ⅱ、向溶解的粗盐中加入过量氯化钡溶液除去硫酸根离子,然后加入过量氢氧化钠溶液除去镁离子,再加入过量碳酸钠溶液除去钙离子及过量的钡离子,过滤后向滤液中加热盐酸调节溶液pH,除去过量的碳酸钠、氢氧化钠杂质,最后通过蒸发、结晶、烘干得到纯净的氯化钠,
(1)第①步为粗盐的溶解,第⑤步为过滤,根据玻璃棒在溶解和过滤操作中的作用解答;
(2)氯化钡可以和硫酸钠反应生成硫酸钡沉淀和氯化钠,加入盐酸可以除去过量的碳酸钠和氢氧化钠;
(3)难溶物质和溶液的分离采用过滤的方法,根据方案流程判断沉淀的成分;
(4)加入氢氧化钾,引进了杂质钾离子;
(5)加入盐酸中和氢氧化钠和过量的碳酸钠,根据反应实质来书写离子方程式.
(1)为了使MgSO4转化为Mg(OH)2,则加入的物质含有氢氧根离子且不阴极新的杂质离子,要使MgSO4完全转化为沉淀,加入试剂的量应为过量;
(2)分离不溶性固体和溶液的方法是过滤;
(3)盐酸和氢氧化镁反应生成氯化镁;
(4)电解熔融氯化镁生成氯气和镁;
Ⅱ、向溶解的粗盐中加入过量氯化钡溶液除去硫酸根离子,然后加入过量氢氧化钠溶液除去镁离子,再加入过量碳酸钠溶液除去钙离子及过量的钡离子,过滤后向滤液中加热盐酸调节溶液pH,除去过量的碳酸钠、氢氧化钠杂质,最后通过蒸发、结晶、烘干得到纯净的氯化钠,
(1)第①步为粗盐的溶解,第⑤步为过滤,根据玻璃棒在溶解和过滤操作中的作用解答;
(2)氯化钡可以和硫酸钠反应生成硫酸钡沉淀和氯化钠,加入盐酸可以除去过量的碳酸钠和氢氧化钠;
(3)难溶物质和溶液的分离采用过滤的方法,根据方案流程判断沉淀的成分;
(4)加入氢氧化钾,引进了杂质钾离子;
(5)加入盐酸中和氢氧化钠和过量的碳酸钠,根据反应实质来书写离子方程式.
解答:
解:Ⅰ、海水中加入氢氧化钠,将硫酸镁转化成氢氧化镁,氢氧化镁与盐酸反应生成氯化镁,通入蒸发浓缩、洗涤干燥得到干燥的氯化镁,然后电解熔融氯化镁获得金属镁,
(1)使MgSO4转化为Mg(OH)2,应选择碱,在转化中不引入新的离子,则试剂①选择NaOH,为了使镁离子完全转化,加入试剂①的量应过量,
故答案为:NaOH;过量;
(2)过滤适用于不溶于水的固体和液体,氢氧化镁不溶于水,所以分离得到Mg(OH)2沉淀的方法是过滤,
故答案为:过滤;
(3)从氢氧化镁到氯化镁,氢氧化镁和盐酸反应得到氯化镁和水,反应的化学方程式为:Mg(OH)2+2HCl=MgCl2+2H2O,所以离子方程式为Mg(OH)2+2H+=Mg2++2H2O,
故答案为:盐酸;Mg(OH)2+2H+=Mg2++2H2O;
(4)氯化镁电解为分解反应,产物为镁和氯气,所以电解方程式为:MgCl2(熔融)
Mg+Cl2↑,
故答案为:MgCl2(熔融)
Mg+Cl2↑;
Ⅱ、向溶解的粗盐中加入过量氯化钡溶液除去硫酸根离子,然后加入过量氢氧化钠溶液除去镁离子,再加入过量碳酸钠溶液除去钙离子及过量的钡离子,过滤后向滤液中加热盐酸调节溶液pH,除去过量的碳酸钠、氢氧化钠杂质,最后通过蒸发、结晶、烘干得到纯净的氯化钠,
(1)第①步为粗盐的溶解,玻璃棒的作用是搅拌,加速粗盐的溶解;第⑤步为过滤,过滤是将固体和液体进行分离的一种操作,玻璃棒在其中的作用是引流,避免溶液洒落,
故答案为:搅拌;引流;
(2)氯化钡可以和硫酸钠反应生成硫酸钡沉淀和氯化钠,步骤②是为了除去硫酸钠;
第⑥步操作加入盐酸,盐酸与氢氧化钠生成氯化钠和水,与碳酸钠生成氯化钠、二氧化碳和水,
故答案为:Na2SO4;HCl、Na2CO3;
(3)第⑤步“过滤”操作中得到沉淀的成分有:泥沙、BaSO4、Mg(OH)2、CaCO3以及BaCO3,
故答案为:CaCO3;BaCO3;
(4)加入氢氧化钠,可以除去溶液中的氯化镁,发生反应的化学方程式为:MgCl2+2NaOH═Mg(OH)2↓+2NaCl,选择的除杂试剂不能用KOH代替NaOH,否则会引入钾离子,
故答案为:会引入新的杂质KCl;
(5)第⑥步加入盐酸,盐酸与氢氧化钠生成氯化钠和水,与碳酸钠生成氯化钠、二氧化碳和水,反应的离子方程式:H++OH-=H2O、CO32-+2H+=H2O+CO2↑,
故答案为:H++OH-=H2O;CO32-+2H+=H2O+CO2↑.
(1)使MgSO4转化为Mg(OH)2,应选择碱,在转化中不引入新的离子,则试剂①选择NaOH,为了使镁离子完全转化,加入试剂①的量应过量,
故答案为:NaOH;过量;
(2)过滤适用于不溶于水的固体和液体,氢氧化镁不溶于水,所以分离得到Mg(OH)2沉淀的方法是过滤,
故答案为:过滤;
(3)从氢氧化镁到氯化镁,氢氧化镁和盐酸反应得到氯化镁和水,反应的化学方程式为:Mg(OH)2+2HCl=MgCl2+2H2O,所以离子方程式为Mg(OH)2+2H+=Mg2++2H2O,
故答案为:盐酸;Mg(OH)2+2H+=Mg2++2H2O;
(4)氯化镁电解为分解反应,产物为镁和氯气,所以电解方程式为:MgCl2(熔融)
| ||
故答案为:MgCl2(熔融)
| ||
Ⅱ、向溶解的粗盐中加入过量氯化钡溶液除去硫酸根离子,然后加入过量氢氧化钠溶液除去镁离子,再加入过量碳酸钠溶液除去钙离子及过量的钡离子,过滤后向滤液中加热盐酸调节溶液pH,除去过量的碳酸钠、氢氧化钠杂质,最后通过蒸发、结晶、烘干得到纯净的氯化钠,
(1)第①步为粗盐的溶解,玻璃棒的作用是搅拌,加速粗盐的溶解;第⑤步为过滤,过滤是将固体和液体进行分离的一种操作,玻璃棒在其中的作用是引流,避免溶液洒落,
故答案为:搅拌;引流;
(2)氯化钡可以和硫酸钠反应生成硫酸钡沉淀和氯化钠,步骤②是为了除去硫酸钠;
第⑥步操作加入盐酸,盐酸与氢氧化钠生成氯化钠和水,与碳酸钠生成氯化钠、二氧化碳和水,
故答案为:Na2SO4;HCl、Na2CO3;
(3)第⑤步“过滤”操作中得到沉淀的成分有:泥沙、BaSO4、Mg(OH)2、CaCO3以及BaCO3,
故答案为:CaCO3;BaCO3;
(4)加入氢氧化钠,可以除去溶液中的氯化镁,发生反应的化学方程式为:MgCl2+2NaOH═Mg(OH)2↓+2NaCl,选择的除杂试剂不能用KOH代替NaOH,否则会引入钾离子,
故答案为:会引入新的杂质KCl;
(5)第⑥步加入盐酸,盐酸与氢氧化钠生成氯化钠和水,与碳酸钠生成氯化钠、二氧化碳和水,反应的离子方程式:H++OH-=H2O、CO32-+2H+=H2O+CO2↑,
故答案为:H++OH-=H2O;CO32-+2H+=H2O+CO2↑.
点评:本题考查了物质的分离、提纯方法及基本操作方法的综合应用,题目难度中等,试题知识点较多、综合性较强,涉及粗盐的提纯、海水资源的综合应用等知识,试题充分考查离子形式的分析、理解能力及化学实验能力.

练习册系列答案
相关题目
绿色化学对于化学反应提出了“原子经济性”(原子节约)的新概念及要求,理想的原子经济性反应是原料分子中的原子全部转化成所需要的产物,不产生副产物,实现零排放.下列反应类型中完全符合要求的是( )
| A、分解反应 | B、置换反应 |
| C、复分解反应 | D、化合反应 |
关于反应:X(s)+3Y(g)?2Z(g)△H<0,下列说法正确的是( )
| A、该反应较高温度下不容易自发进行,在低温下容易自发进行 |
| B、增大压强,X、Y、Z浓度均增大,正、逆反应速率均加快 |
| C、升高温度,反应活化能降低,反应速率加快 |
| D、其他条件不变,增大反应物浓度,平衡常数增大 |
根据下表下列叙述正确的是( )
| 序号 | 氧化剂 | 还原剂 | 其它反应物 | 氧化产物 | 还原产物 |
| ① | Cl2 | FeBr2 | FeCl3 | ||
| ② | KMnO4 | H2O2 | H2SO4 | O2 | MnSO4 |
| ③ | KClO3 | HCl(浓) | Cl2 | Cl2 | |
| ④ | KMnO4 | HCl(浓) | Cl2 | MnCl2 |
| A、表中第①组反应的氧化产物中一定有FeCl3 |
| B、氧化性比较:KMnO4>Cl2>Fe3+>Br2>Fe2+ |
| C、还原性比较:H2O2>Mn2+>Cl- |
| D、④的离子方程式配平后,H+的化学计量数为16 |
下列化学反应的速率,一定是前者大于后者的( )
A、反应A+B
| ||||
| B、相同温度下,与同浓度盐酸反应的锌粉和铁粉产生氢气的速率 | ||||
| C、相同温度下,颗粒大小相同的生铁分别在水和饱和食盐水中的腐蚀生锈 | ||||
| D、一定温度下,相同氢离子浓度、相同体积的盐酸与硫酸分别与大小相同的锌片反应,产生气泡的快慢 |
下列图示装置的实验中,操作正确的是( )


| A、图1配制250 mL 0.10 mol?L-1盐酸 |
| B、图2稀释浓硫酸 |
| C、图3称量氯化钠固体 |
| D、图4检验铁粉与水蒸气反应产生的氢气 |


 已知:A、B、C、D、E、F五种元素核电荷数依次增大,属周期表中前四周期的元素.其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中是最高的;F原子核外最外层电子数与B相同,其余各层均充满.请根据以上信息,回答下列问题:
已知:A、B、C、D、E、F五种元素核电荷数依次增大,属周期表中前四周期的元素.其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中是最高的;F原子核外最外层电子数与B相同,其余各层均充满.请根据以上信息,回答下列问题: