题目内容
某同学设计如下实验方案,以分离KCl和BaCl2两种固体混合物
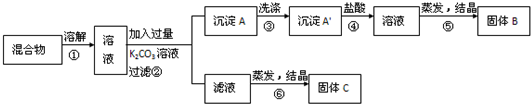
试回答下列问题:
(1)B物质的化学式为 .
(2)该方案的明显失误是因某一步设计不当而使分离产物不纯,该步正确的方案应是 .
(3)若要测定原混合物中KCl和BaCl2的质量分数,除了要准确称量混合物的质量外,至少还要获得的数据是 .

试回答下列问题:
(1)B物质的化学式为
(2)该方案的明显失误是因某一步设计不当而使分离产物不纯,该步正确的方案应是
(3)若要测定原混合物中KCl和BaCl2的质量分数,除了要准确称量混合物的质量外,至少还要获得的数据是
考点:物质分离和提纯的方法和基本操作综合应用
专题:化学实验基本操作
分析:分离KCl和BaCl2两种固体混合物,可先溶于水,然后加入过量K2CO3使BaCl2转化为A碳酸钡沉淀,过滤后沉淀加入盐酸可生成BaCl2溶液,经⑤蒸发、结晶后可得B固体BaCl2,操作②所得滤液为KCl和K2CO3的混合物,应加入过量盐酸可得KCl,固体C为KCl,据此进行解答.
解答:
解:分离KCl和BaCl2两种固体混合物,可先溶于水,然后加入过量K2CO3使BaCl2转化为A碳酸钡沉淀,过滤后沉淀加入盐酸可生成BaCl2溶液,经⑤蒸发、结晶后可得B固体BaCl2,操作②所得滤液为KCl和K2CO3的混合物,应加入过量盐酸可得KCl,固体C为KCl;
(1)氯化钾和氯化钡溶液中加入碳酸钾溶液可以生成碳酸钡沉淀,则沉淀A为BaCO3;过滤后碳酸钡沉淀中加入盐酸可生成BaCl2溶液,经⑤蒸发、结晶后可得B固体BaCl2,故答案为:BaCl2;
(2)蒸发结晶前应加入适量稀盐酸,将过量的碳酸钾转化成氯化钾,否则晶体不纯,
故答案为:应先在⑥步操作前的滤液中加足量盐酸后,蒸发结晶;
(3)固体溶解后加入过量K2CO3使BaCl2转化为碳酸钡沉淀,过滤后沉淀加入试剂b盐酸可将碳酸钡转化成BaCl2溶液,然后经蒸发、结晶、干燥后可得固体BaCl2,若要测定原混合物中KCl和BaCl2的质量分数,除了要准确称量混合物的质量外,至少还要获得的数据是固体B或沉淀A’的质量,依据B为BaCl2计算得到质量分数,A'为碳酸钡,结合钡元素守恒计算氯化钡质量得到,
故答案为:固体B或沉淀A’的质量.
(1)氯化钾和氯化钡溶液中加入碳酸钾溶液可以生成碳酸钡沉淀,则沉淀A为BaCO3;过滤后碳酸钡沉淀中加入盐酸可生成BaCl2溶液,经⑤蒸发、结晶后可得B固体BaCl2,故答案为:BaCl2;
(2)蒸发结晶前应加入适量稀盐酸,将过量的碳酸钾转化成氯化钾,否则晶体不纯,
故答案为:应先在⑥步操作前的滤液中加足量盐酸后,蒸发结晶;
(3)固体溶解后加入过量K2CO3使BaCl2转化为碳酸钡沉淀,过滤后沉淀加入试剂b盐酸可将碳酸钡转化成BaCl2溶液,然后经蒸发、结晶、干燥后可得固体BaCl2,若要测定原混合物中KCl和BaCl2的质量分数,除了要准确称量混合物的质量外,至少还要获得的数据是固体B或沉淀A’的质量,依据B为BaCl2计算得到质量分数,A'为碳酸钡,结合钡元素守恒计算氯化钡质量得到,
故答案为:固体B或沉淀A’的质量.
点评:本题考查物质的分离、提纯操作,题目难度中等,注意把握物质的性质,根据性质选择反应试剂,把握化学基本实验操作方法的知识.

练习册系列答案
 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目
NA代表阿伏加德罗常数的数值,下列叙述正确的是( )
| A、在 H2O2+Cl2=2HCl+O2反应中,每生成32 gO2,转移4NA个电子 |
| B、一定条件下,56 g Fe与33.6 L Cl2充分反应,转移电子数一定为3NA |
| C、标准状况下分子数为NA的CO、C2H4混合气体体积约为22.4 L,质量为28 g |
| D、在1 L 0.2 mol?L-1的硫酸铝溶液中含有的铝离子数为0.4NA |
关于反应:X(s)+3Y(g)?2Z(g)△H<0,下列说法正确的是( )
| A、该反应较高温度下不容易自发进行,在低温下容易自发进行 |
| B、增大压强,X、Y、Z浓度均增大,正、逆反应速率均加快 |
| C、升高温度,反应活化能降低,反应速率加快 |
| D、其他条件不变,增大反应物浓度,平衡常数增大 |
某温度下,在一容积固定的容器中,反应aA(g)+bB(g)═hH(g)达到平衡后,A、B、H的物质的量分别为a mol、b mol和h mol.已知a+b=2h,若保持温度不变,将三者的物质的量增大一倍,则下列判断正确的是( )
| A、平衡不移动 |
| B、混合气体的密度不变 |
| C、B的体积分数增大 |
| D、a mol/L<c(A)<2a mol/L |
根据下表下列叙述正确的是( )
| 序号 | 氧化剂 | 还原剂 | 其它反应物 | 氧化产物 | 还原产物 |
| ① | Cl2 | FeBr2 | FeCl3 | ||
| ② | KMnO4 | H2O2 | H2SO4 | O2 | MnSO4 |
| ③ | KClO3 | HCl(浓) | Cl2 | Cl2 | |
| ④ | KMnO4 | HCl(浓) | Cl2 | MnCl2 |
| A、表中第①组反应的氧化产物中一定有FeCl3 |
| B、氧化性比较:KMnO4>Cl2>Fe3+>Br2>Fe2+ |
| C、还原性比较:H2O2>Mn2+>Cl- |
| D、④的离子方程式配平后,H+的化学计量数为16 |
下列各组离子在溶液中既可以大量共存,且加入氢氧化钠溶液后也不产生沉淀的是( )
| A、Na+、Ba2+、Cl-、SO42- |
| B、K+、Na+、NO3-、OH- |
| C、H+、NH4+、Fe3+、SO42- |
| D、H+、Cl-、CH3COO-、NO3- |
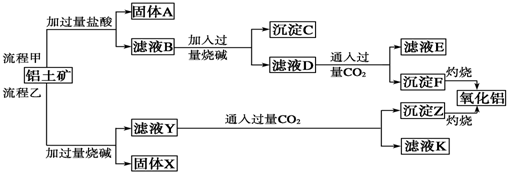
 已知:A、B、C、D、E、F五种元素核电荷数依次增大,属周期表中前四周期的元素.其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中是最高的;F原子核外最外层电子数与B相同,其余各层均充满.请根据以上信息,回答下列问题:
已知:A、B、C、D、E、F五种元素核电荷数依次增大,属周期表中前四周期的元素.其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中是最高的;F原子核外最外层电子数与B相同,其余各层均充满.请根据以上信息,回答下列问题: