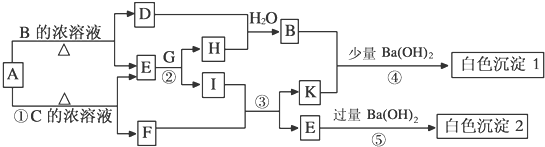
题目内容
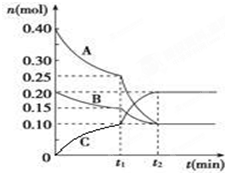 现将0.4mol A气体和0.2mol B气体充入10L的密闭容器中,在一定条件下使其发生反应生成气体C,其物质的量随时间的变化如图:
现将0.4mol A气体和0.2mol B气体充入10L的密闭容器中,在一定条件下使其发生反应生成气体C,其物质的量随时间的变化如图:(1)若t1=10min,则0至t1时间内C物质的平均反应速率为
(2)据图中曲线变化情况分析,t1时刻改变的反应条件可能是
A.加入了催化剂 B.降低了反应温度
C.向容器中充入了C D.缩小了容器体积.
考点:化学平衡的影响因素,物质的量或浓度随时间的变化曲线
专题:化学平衡专题
分析:(1)根据v=
计算反应速率;根据反应中各物质的变化的物质的量之比等于计量数之比,可写出化学方程式;
(2)根据影响化学反应速率和化学平衡的条件可作判断.
| △c |
| △t |
(2)根据影响化学反应速率和化学平衡的条件可作判断.
解答:
解:(1)t1=10min,0至t1时间内C物质的平均反应速率为
=
=1.0×10-3mol-1min-1;
根据图可知,A、B的物质的量在减小,为反应物,C的物质的量增加,为生成物,且有△n(A)=0.40mol-0.10mol=0.30mol,△n(B)=0.20mol-0.10mol=0.10mol,△n(C)=0.20mol-0mol=0.20mol,再根据反应中各物质的变化的物质的量之比等于计量数之比,可写出化学方程式为3A(g)+B(g)?2C(g),
故答案为:1.0×10-3mol-1min-1;3A(g)+B(g)?2C(g);
(2)根据图可知,在t1时刻,A、B物质在原来的基础上逐渐减小,C物质在原来的基础上逐渐增大,说明平衡正向移动,而该反应是体积减小的反应,所改变条件为缩小容器的体积,故选D.
| △c |
| △t |
| ||
| 10min |
根据图可知,A、B的物质的量在减小,为反应物,C的物质的量增加,为生成物,且有△n(A)=0.40mol-0.10mol=0.30mol,△n(B)=0.20mol-0.10mol=0.10mol,△n(C)=0.20mol-0mol=0.20mol,再根据反应中各物质的变化的物质的量之比等于计量数之比,可写出化学方程式为3A(g)+B(g)?2C(g),
故答案为:1.0×10-3mol-1min-1;3A(g)+B(g)?2C(g);
(2)根据图可知,在t1时刻,A、B物质在原来的基础上逐渐减小,C物质在原来的基础上逐渐增大,说明平衡正向移动,而该反应是体积减小的反应,所改变条件为缩小容器的体积,故选D.
点评:本题考查了根据图象写化学方程式、计算反应速率及影响反应速率和化学平衡移动的外界因素等知识,难度不大.

练习册系列答案
相关题目
下列表述正确的是( )
| A、将 0.1 mol?L-1HCl溶液加热到100℃,溶液的pH仍为1 |
| B、将pH=4的醋酸溶液加水稀释后,溶液中所有离子的浓度均降低 |
| C、若1mLpH=1的盐酸与10mLNaOH溶液混合后溶液的pH=7,则NaOH溶液的pH=12 |
| D、在滴有酚酞试液的氨水中,加入NH4Cl至溶液呈无色,此时溶液一定显中性 |
室温下,下列各组离子在指定溶液中能大量共存的( )
A、pH=1的溶液中K+ CrO
| ||||||
B、饱和氯水中Cl- NO
| ||||||
C、能使pH试纸变红的溶液NH
| ||||||
D、FeCl2溶液中K+ Na+ SO
|
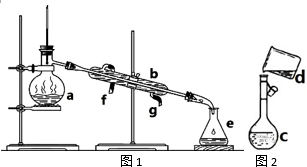 掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置.
掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置.