题目内容
现代工业将煤炭气化,既可以提高燃料的利用率、减少CO、SO2等的排放,又可以扩大水煤气的广泛用途.
(1)已知:①2C(s)+O2(g)=2CO(g)△H1;
②2H2(g)+O2(g)=2H2O(l)△H2;
③H2O(g)=H2O(l)△H3.
则反应C(s)+H2O(g)=CO(g)+H2(g)△H= (用含△H1、△H2、△H3的代数式表示)
(2)CO和H2在一定条件下合成甲醇的反应为:CO(g)+2H2(g)?CH3OH(g)△H4.
现在容器均为10L的a、b、c、d、e五个密闭容器中分别充入10mol CO和20mol H2的混合气体,控制温度进行实验,测得相关数据如图1和图2.

①该反应的△H4 0(填“>”、“<”或“=”,下同);该反应平衡常数的关系为K1 K2;
②300℃时,从反应开始到达到化学平衡,以H2浓度变化表示的化学反应速率是 ;计算出此温度下的平衡常数为 .
③500℃时,将容器的容积压缩至原来的1/2,在其他条件不变的情况下,对平衡体系产生的影响是 (填字母).
a.H2的体积分数减小 b.正反应速率加快,逆反应速率减慢
c.气体压强增加一倍 d.重新平衡时c(H2)/c(CH3OH)减小
④从平衡状态c转到d(见图2),除升高温度外,还可以采用的措施有 (写出一条即可).判断该可逆反应在c装置中达到化学平衡状态的标志是 (填字母).
a.v (CO消耗)=2v (H2生成) b.混合气体的密度不再改变
c.混合气体的平均分子质量不再改变 d.CO、H2、CH3OH的浓度之比为1:2:1.
(1)已知:①2C(s)+O2(g)=2CO(g)△H1;
②2H2(g)+O2(g)=2H2O(l)△H2;
③H2O(g)=H2O(l)△H3.
则反应C(s)+H2O(g)=CO(g)+H2(g)△H=
(2)CO和H2在一定条件下合成甲醇的反应为:CO(g)+2H2(g)?CH3OH(g)△H4.
现在容器均为10L的a、b、c、d、e五个密闭容器中分别充入10mol CO和20mol H2的混合气体,控制温度进行实验,测得相关数据如图1和图2.

①该反应的△H4
②300℃时,从反应开始到达到化学平衡,以H2浓度变化表示的化学反应速率是
③500℃时,将容器的容积压缩至原来的1/2,在其他条件不变的情况下,对平衡体系产生的影响是
a.H2的体积分数减小 b.正反应速率加快,逆反应速率减慢
c.气体压强增加一倍 d.重新平衡时c(H2)/c(CH3OH)减小
④从平衡状态c转到d(见图2),除升高温度外,还可以采用的措施有
a.v (CO消耗)=2v (H2生成) b.混合气体的密度不再改变
c.混合气体的平均分子质量不再改变 d.CO、H2、CH3OH的浓度之比为1:2:1.
考点:物质的量或浓度随时间的变化曲线,化学平衡的影响因素,化学平衡状态的判断
专题:化学平衡专题
分析:(1)依据热化学方程式和盖斯定律计算得到;
(2)①根据图1升判断出温度对平衡的影响,从图象可以看出,升高温度,甲醇的物质的量减少,说明正反应是放热反应;根据正反应是放热反应,温度降低,平衡正向移动,平衡常数增大;
②利用三段式进行计算;根据平衡常数的定义计算;
③该反应为体积减小的反应,容积压缩至原来的1/2,增大压强,正逆反应速率都增大,平衡正向移动,氢气的体积分数减小,c(H2)/c(CH3OH)减小,平衡移动后压强小于原来的2倍,据此判断;
④从平衡状态c转到d,甲醇含量下降,说明平衡逆向移动,可以采用减小压强的措施,根据平衡状态的判断标志作判断.
(2)①根据图1升判断出温度对平衡的影响,从图象可以看出,升高温度,甲醇的物质的量减少,说明正反应是放热反应;根据正反应是放热反应,温度降低,平衡正向移动,平衡常数增大;
②利用三段式进行计算;根据平衡常数的定义计算;
③该反应为体积减小的反应,容积压缩至原来的1/2,增大压强,正逆反应速率都增大,平衡正向移动,氢气的体积分数减小,c(H2)/c(CH3OH)减小,平衡移动后压强小于原来的2倍,据此判断;
④从平衡状态c转到d,甲醇含量下降,说明平衡逆向移动,可以采用减小压强的措施,根据平衡状态的判断标志作判断.
解答:
解:(1)2C(s)+O2(g)=2CO(g)△H1 ①
2H2(g)+O2(g)=2H2O(g)△H2 ②
盖斯定律得①-②得:2C(s)+2H2O(g)?2CO(g)+2H2(g)△H1-△H2,
则反应C(s)+H2O(g)?CO(g)+H2(g)△H=
;
故答案为:
;
(2)①图1可以看出,甲醇的物质的量为0.6mol的曲线温度大,说明升高温度,甲醇的物质的量减少,即平衡逆向移动,说明正反应是放热反应,所以△H3<0;
因正反应是放热反应,温度降低,平衡正向移动,平衡常数增大,所以说低温时平衡常数大;
故答案为:<;>;
②利用三段式
CO(g)+2H2(g)?CH3OH(g)
起始(mol) 10 20 0
转化(mol) 8 16 8
平衡(mol) 2 4 8
H2的反应速率为
=0.04mol/(L?min)
平衡常数为
=
=25,
故答案为:0.04mol/(L?min);25;
③该反应为体积减小的反应,容积压缩至原来的1/2,增大压强,正逆反应速率都增大,平衡正向移动,氢气的体积分数减小,c(H2)/c(CH3OH)减小,平衡移动后压强小于原来的2倍,故选ad;
④从平衡状态c转到d,甲醇含量下降,说明平衡逆向移动,可以采用减小压强的措施,根据平衡状态的判断标志可知:
a.当2v (CO消耗)=v (H2生成)时,正逆反应才相等,故不能说明反应处于平衡状态;
b.反应前后体积不变,气体质量守恒,所以混合气体的密度不变,不能说明反应处于平衡状态;
c.反应前后气体的物质的量变化,质量守恒,所以混合气体的平均分子质量不再改变时,说明反应处于平衡状态;
d.CO、H2、CH3OH的浓度之比为1:2:1,不能说明反应处于平衡状态;
故答案为:减小压强;c.
2H2(g)+O2(g)=2H2O(g)△H2 ②
盖斯定律得①-②得:2C(s)+2H2O(g)?2CO(g)+2H2(g)△H1-△H2,
则反应C(s)+H2O(g)?CO(g)+H2(g)△H=
| △H1-△H2 |
| 2 |
故答案为:
| △H1-△H2 |
| 2 |
(2)①图1可以看出,甲醇的物质的量为0.6mol的曲线温度大,说明升高温度,甲醇的物质的量减少,即平衡逆向移动,说明正反应是放热反应,所以△H3<0;
因正反应是放热反应,温度降低,平衡正向移动,平衡常数增大,所以说低温时平衡常数大;
故答案为:<;>;
②利用三段式
CO(g)+2H2(g)?CH3OH(g)
起始(mol) 10 20 0
转化(mol) 8 16 8
平衡(mol) 2 4 8
H2的反应速率为
| ||
| 40min |
平衡常数为
| c(CH3OH) |
| c(CO)?c2(H2) |
| ||||
|
故答案为:0.04mol/(L?min);25;
③该反应为体积减小的反应,容积压缩至原来的1/2,增大压强,正逆反应速率都增大,平衡正向移动,氢气的体积分数减小,c(H2)/c(CH3OH)减小,平衡移动后压强小于原来的2倍,故选ad;
④从平衡状态c转到d,甲醇含量下降,说明平衡逆向移动,可以采用减小压强的措施,根据平衡状态的判断标志可知:
a.当2v (CO消耗)=v (H2生成)时,正逆反应才相等,故不能说明反应处于平衡状态;
b.反应前后体积不变,气体质量守恒,所以混合气体的密度不变,不能说明反应处于平衡状态;
c.反应前后气体的物质的量变化,质量守恒,所以混合气体的平均分子质量不再改变时,说明反应处于平衡状态;
d.CO、H2、CH3OH的浓度之比为1:2:1,不能说明反应处于平衡状态;
故答案为:减小压强;c.
点评:本题主要考查盖斯定律、反应速率的计算、平衡常数的计算、影响平衡的因互等知识点,中等难度.

练习册系列答案
相关题目
某有机物结构简式如图所示(未表示出其空间构型).下列它的性质描述不正确的是( )
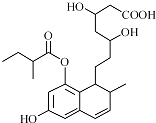

| A、能与FeCl3 溶液发生显色反应 |
| B、能使酸性KMnO4溶液褪色 |
| C、能发生加成、取代、消去反应 |
| D、1mol该物质最多可与3mol NaOH反应 |
下列热化学方程式或离子方程式中,正确的是( )
| A、从酸化的海带灰浸出液中提取碘:2I-+H2O2=I2+2OH- |
| B、向Mg(HCO3)2溶液中加入过量的澄清石灰水:Mg2++2HCO3-+2OH一+Ca2+═MgCO3↓+CaCO3↓+2H2O |
| C、乙烯的燃烧热为akJ/mol(a>0),则乙烯燃烧的热化学方程式可表示为:C2H4(g)+3O2(g)═2CO2(g)+2H2O(g)△H=-akJ/mol |
| D、Ba(OH)2溶液中加入过量的Al2(SO4)3溶液:3Ba2++6OH-+2Al3++3SO42-═3BaSO4↓+2Al(OH)3↓ |
 现将0.4mol A气体和0.2mol B气体充入10L的密闭容器中,在一定条件下使其发生反应生成气体C,其物质的量随时间的变化如图:
现将0.4mol A气体和0.2mol B气体充入10L的密闭容器中,在一定条件下使其发生反应生成气体C,其物质的量随时间的变化如图: ,作为一种解热镇痛药,对于感冒发烧,它有较好的疗效,但大剂量长期空腹服用,容易对胃肠道产生刺激,原因是阿司匹林在胃中会发生酯的水解反应,生成(用结构简式表示)
,作为一种解热镇痛药,对于感冒发烧,它有较好的疗效,但大剂量长期空腹服用,容易对胃肠道产生刺激,原因是阿司匹林在胃中会发生酯的水解反应,生成(用结构简式表示)
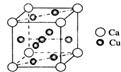 是金属Ca和Cu所形成的某种合金的晶胞结构示意图,则该合金中Ca和Cu的原子个数比为
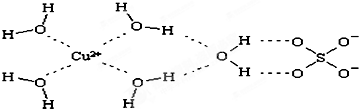
是金属Ca和Cu所形成的某种合金的晶胞结构示意图,则该合金中Ca和Cu的原子个数比为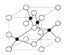 是铜的某种氧化物的晶胞结构示意图,该晶体的密度为a g/cm3,设阿伏伽德罗常数的值为NA,则该晶胞的体积为
是铜的某种氧化物的晶胞结构示意图,该晶体的密度为a g/cm3,设阿伏伽德罗常数的值为NA,则该晶胞的体积为