题目内容
下列表述正确的是( )
| A、将 0.1 mol?L-1HCl溶液加热到100℃,溶液的pH仍为1 |
| B、将pH=4的醋酸溶液加水稀释后,溶液中所有离子的浓度均降低 |
| C、若1mLpH=1的盐酸与10mLNaOH溶液混合后溶液的pH=7,则NaOH溶液的pH=12 |
| D、在滴有酚酞试液的氨水中,加入NH4Cl至溶液呈无色,此时溶液一定显中性 |
考点:pH的简单计算,弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:A.氯化氢具有挥发性,加热到100℃时溶液中氯化氢的浓度小于0.1mol/L;
B.醋酸为弱酸,稀释过程中溶液中氢离子浓度减小,水的离子积不变,则溶液中氢氧根离子浓度增大;
C.设出氢氧化钠溶液的浓度,根据酸碱中和反应实质列式计算出氢氧化钠溶液浓度及溶液的pH;
D.酚酞的变色范围为8-10,溶液的pH小于8时,溶液为无色,此时的溶液的pH不一定为7.
B.醋酸为弱酸,稀释过程中溶液中氢离子浓度减小,水的离子积不变,则溶液中氢氧根离子浓度增大;
C.设出氢氧化钠溶液的浓度,根据酸碱中和反应实质列式计算出氢氧化钠溶液浓度及溶液的pH;
D.酚酞的变色范围为8-10,溶液的pH小于8时,溶液为无色,此时的溶液的pH不一定为7.
解答:
解:A.将0.1 mol?L-1HCl溶液加热到100℃,氯化氢具有挥发性,则加热后的溶液中氯化氢的浓度小于0.1mol/L,溶液的pH大于1,故A错误;
B.将pH=4的醋酸溶液加水稀释后,溶液中氢离子浓度减小,由于水的离子积不变,则溶液中氢氧根离子浓度增大,故B错误;
C.若1mLpH=1的盐酸与10mLNaOH溶液混合后溶液的pH=7,则n(HCl)=n(NaOH),则氢氧化钠的浓度为:c(NaOH)=
=0.01mol/L,则NaOH溶液的pH=12,故C正确;
D.滴有酚酞试液的氨水中,加入NH4Cl至溶液呈无色,溶液pH小于8时溶液为无色,只能说明此时溶液的pH小于8,但溶液不一定显中性,故D错误;
故选C.
B.将pH=4的醋酸溶液加水稀释后,溶液中氢离子浓度减小,由于水的离子积不变,则溶液中氢氧根离子浓度增大,故B错误;
C.若1mLpH=1的盐酸与10mLNaOH溶液混合后溶液的pH=7,则n(HCl)=n(NaOH),则氢氧化钠的浓度为:c(NaOH)=
| 1×10-3L×0.1mol/L |
| 0.01L |
D.滴有酚酞试液的氨水中,加入NH4Cl至溶液呈无色,溶液pH小于8时溶液为无色,只能说明此时溶液的pH小于8,但溶液不一定显中性,故D错误;
故选C.
点评:本题考查了溶液pH的计算,题目难度中等,注意掌握溶液酸碱性与溶液pH的关系,明确酸碱混合液的pH的计算方法,试题培养了学生的分析、理解能力及灵活应用所学知识的能力.

练习册系列答案
相关题目
 黄曲霉素的结构如下,1mol该化合物分别与H2、NaOH溶液反应最多消耗H2和NaOH的物质的量分别为( )
黄曲霉素的结构如下,1mol该化合物分别与H2、NaOH溶液反应最多消耗H2和NaOH的物质的量分别为( )| A、6mol,1mol |
| B、7mol,1mol |
| C、6mol,2mol |
| D、7mol,2mol |
某气体可能含有N2、HCl、CO中的一种或几种,将其依次通入足量NaHCO3溶液和灼热CuO,气体的体积都没有变化,再通过足量的碱石灰,气体体积减小,但还有剩余气体,以下对该气体组分判断正确的是( )
| A、一定没有N2,CO和HCl至少有1种 |
| B、一定有N2,HCl和CO |
| C、一定有N2,CO和HCl至少有1种 |
| D、一定有N2和CO,没有HCl |
设NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A、在标准状况下,以任意比例混合的CH4与CO2 的混合物22.4L,所含有的分子数为NA |
| B、在标准状况下,NA个H2O 分子所占体积为22.4L |
| C、常温常压下,活泼金属从盐酸中置换出1molH2,发生转移的电子数为2NA |
| D、常温常压下,28g氮气含有的核外电子数为10 NA |
下列离子方程式书写正确的是( )
A、澄清石灰水与过量NaHCO3溶液混合:Ca2++OH-+HCO
| ||
B、向次氯酸钠溶液中通入足量SO2气体:ClO-+SO2+H2O=HClO+HSO
| ||
| C、锌和稀硝酸的反应:Zn2++2H+=Zn2++H2 | ||
| D、CuSO4溶液吸收H2S气体:Cu2++H2S=CuS↓+2H+ |
下列关于有机物的说法中错误的是( )
| A、甲苯、葡萄糖和乙醇均能使酸性高锰酸钾溶液褪色 |
| B、在鸡蛋白溶液中加入浓Na2SO4溶液,蛋白质发生变性 |
| C、乙酸乙酯、油脂与NaOH溶液反应均有醇生成 |
| D、分子式为C7H8O属于芳香族化合物的同分异构体有5种 |
某有机物结构简式如图所示(未表示出其空间构型).下列它的性质描述不正确的是( )
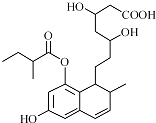

| A、能与FeCl3 溶液发生显色反应 |
| B、能使酸性KMnO4溶液褪色 |
| C、能发生加成、取代、消去反应 |
| D、1mol该物质最多可与3mol NaOH反应 |
几种短周期元素的原子半径及主要化合价如下表:
下列叙述正确的是( )
| 元素代号 | L | X | R | T |
| 原子半径/nm | 0.191 | 0.102 | 0.154 | 0.074 |
| 主要化合价 | +1 | +6、-2 | +1 | -2 |
| A、L单质的熔点比R单质的高 |
| B、T对应的氢化物的沸点比X对应的氢化物高 |
| C、R单质在氧气中燃烧生成R2O2 |
| D、L、X形成的简单离子核外电子数相等 |
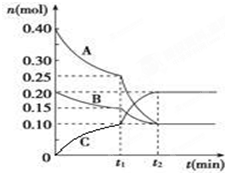 现将0.4mol A气体和0.2mol B气体充入10L的密闭容器中,在一定条件下使其发生反应生成气体C,其物质的量随时间的变化如图:
现将0.4mol A气体和0.2mol B气体充入10L的密闭容器中,在一定条件下使其发生反应生成气体C,其物质的量随时间的变化如图: