题目内容
黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物.
(1)冶炼铜的反应为8CuFeS2+21O2
8Cu+4FeO+2Fe2O3+16SO2
若CuFeS2中Fe的化合价为+2,反应中被还原的元素 (填元素符号).
(2)上述冶炼过程中产生大量SO2.下列处理方案合理的是 (填代号).
a.高空排放
b.用于制备硫酸
c.用纯碱溶液吸收制Na2SO3
d.用浓硫酸吸收
(3)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3.方法为:
①用稀盐酸浸取炉渣,过滤.
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧制得.
据以上信息回答下列问题:
选用提供的试剂,设计实验验证炉渣中含有FeO.
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水
所选试剂为 .证明炉渣中含有FeO的实验现象为 .
(1)冶炼铜的反应为8CuFeS2+21O2
| ||
若CuFeS2中Fe的化合价为+2,反应中被还原的元素
(2)上述冶炼过程中产生大量SO2.下列处理方案合理的是
a.高空排放
b.用于制备硫酸
c.用纯碱溶液吸收制Na2SO3
d.用浓硫酸吸收
(3)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3.方法为:
①用稀盐酸浸取炉渣,过滤.
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧制得.
据以上信息回答下列问题:
选用提供的试剂,设计实验验证炉渣中含有FeO.
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水
所选试剂为
考点:氧化还原反应,物质的分离、提纯的基本方法选择与应用,物质的检验和鉴别的基本方法选择及应用
专题:实验设计题,元素及其化合物
分析:(1)8CuFeS2+21O2
8Cu+4FeO+2Fe2O3+16SO2中,Fe元素的化合价升高,Cu、O元素的化合价降低;
(2)冶炼过程中产生大量SO2可制备硫酸或利用碱液吸收;
(3)设计实验验证炉渣中含有FeO,利用酸溶液后,根据亚铁离子具有还原性,选氧化剂发生明显的现象来解答.
| ||
(2)冶炼过程中产生大量SO2可制备硫酸或利用碱液吸收;
(3)设计实验验证炉渣中含有FeO,利用酸溶液后,根据亚铁离子具有还原性,选氧化剂发生明显的现象来解答.
解答:
解:(1)8CuFeS2+21O2
8Cu+4FeO+2Fe2O3+16SO2中,Fe元素的化合价升高,Cu、O元素的化合价降低,则Cu、O元素被还原,故答案为:Cu、O;
(2)冶炼过程中产生大量SO2可制备硫酸或利用碱液吸收,与浓硫酸不反应,也不能直接排放,故答案为:bc;
(3)设计实验验证炉渣中含有FeO,利用酸溶液后,根据亚铁离子具有还原性,选氧化剂发生明显的现象即可证明,因盐酸能被高锰酸钾氧化,则选择试剂为稀硫酸、KMnO4溶液,证明炉渣中含有FeO的实验现象为稀硫酸浸取炉渣所得溶液能使KMnO4溶液褪色,
故答案为:稀硫酸、KMnO4溶液;稀硫酸浸取炉渣所得溶液能使KMnO4溶液褪色.
| ||
(2)冶炼过程中产生大量SO2可制备硫酸或利用碱液吸收,与浓硫酸不反应,也不能直接排放,故答案为:bc;
(3)设计实验验证炉渣中含有FeO,利用酸溶液后,根据亚铁离子具有还原性,选氧化剂发生明显的现象即可证明,因盐酸能被高锰酸钾氧化,则选择试剂为稀硫酸、KMnO4溶液,证明炉渣中含有FeO的实验现象为稀硫酸浸取炉渣所得溶液能使KMnO4溶液褪色,
故答案为:稀硫酸、KMnO4溶液;稀硫酸浸取炉渣所得溶液能使KMnO4溶液褪色.
点评:本题考查氧化还原反应及应用,为高频考点,把握物质的性质、反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,(3)中易错选盐酸,题目难度不大.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
只用滴管、试管和水就能鉴别的物质组是( )
| A、苯、乙酸、CCl4 |
| B、乙醇、乙醛、乙酸 |
| C、乙二醇、乙醛、溴代烃 |
| D、乙醇、甘油、苯酚 |
某一元醇C3H8O中氧为18O,它与乙酸反应生成的酯的相对分子质量为( )
| A、100 | B、102 |
| C、104 | D、106 |
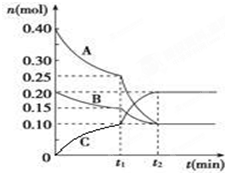 现将0.4mol A气体和0.2mol B气体充入10L的密闭容器中,在一定条件下使其发生反应生成气体C,其物质的量随时间的变化如图:
现将0.4mol A气体和0.2mol B气体充入10L的密闭容器中,在一定条件下使其发生反应生成气体C,其物质的量随时间的变化如图: