题目内容
7.胃液中含有盐酸,胃酸过多的人常有胃疼烧心的感觉,易吐酸水,服用适量的小苏打(NaHCO3),能治疗胃酸过多,请写出其反应的化学方程式:NaHCO3+HCl=NaCl+H2O+CO2,离子方程式:H++HCO3-=H2O+CO2↑.分析 碳酸氢钠与盐酸反应生成氯化钠、水、二氧化碳,据此写出化学方程式和离子方程式.
解答 解:胃酸的主要成分为盐酸,盐酸能够与碳酸氢钠发生反应,化学方程式为NaHCO3+HCl=NaCl+H2O+CO2,离子方程式为:H++HCO3-=H2O+CO2↑,
故答案为:NaHCO3+HCl=NaCl+H2O+CO2;H++HCO3-=H2O+CO2↑.
点评 本题考查了碳酸氢钠的性质,明确碳酸氢钠的性质,掌握离子方程式书写的方法和注意事项是解题关键,题目难度不大.

练习册系列答案
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案
相关题目
18.一定条件下的密闭容器中:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-905.9kJ•mol-1,下列叙述正确的是( )
| A. | 4molNH3和5molO2反应,达到平衡时放出热量为905.9kJ | |
| B. | 平衡时v正(O2)=v逆(NO) | |
| C. | 平衡后降低压强,混合气体平均摩尔质量增大 | |
| D. | 平衡后升高温度,混合气体中NO含量降低 |
15.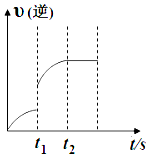 已知反应:C(s)+H2O(g)?CO(g)+H2(g)△H>0,某温度下,向5L密闭容器中加入2mol C(s)与1mol H2O(g),t1s时,CO的物质的量为0.20mol,到第t2s时恰好达到平衡,此时CO的物质的量为0.35mol,下列说法正确的是( )
已知反应:C(s)+H2O(g)?CO(g)+H2(g)△H>0,某温度下,向5L密闭容器中加入2mol C(s)与1mol H2O(g),t1s时,CO的物质的量为0.20mol,到第t2s时恰好达到平衡,此时CO的物质的量为0.35mol,下列说法正确的是( )
 已知反应:C(s)+H2O(g)?CO(g)+H2(g)△H>0,某温度下,向5L密闭容器中加入2mol C(s)与1mol H2O(g),t1s时,CO的物质的量为0.20mol,到第t2s时恰好达到平衡,此时CO的物质的量为0.35mol,下列说法正确的是( )
已知反应:C(s)+H2O(g)?CO(g)+H2(g)△H>0,某温度下,向5L密闭容器中加入2mol C(s)与1mol H2O(g),t1s时,CO的物质的量为0.20mol,到第t2s时恰好达到平衡,此时CO的物质的量为0.35mol,下列说法正确的是( )| A. | t1时改变的条件可能是使用催化剂 | |
| B. | t1时改变的条件可能是增大 H2O 浓度 | |
| C. | t1~t2这段时间内的化学反应速率 v(H2O)=$\frac{{t}_{2}-{t}_{1}}{0.15}$ | |
| D. | t2后继续加入 2 mol C(s)平衡向正反应方向移动 |
2.下列措施对增大反应速率明显有效的是( )
| A. | Na与水反应时增大水的用量 | |
| B. | Fe与稀硫酸反应制取H2时,改用浓硫酸 | |
| C. | 在K2SO4与BaCl2两溶液反应时,增大反应容器体积 | |
| D. | Al在氧气中燃烧生成Al2O3,将Al片改成Al粉 |
19.下列物质在水溶液中的电离方程式书写完全正确的是( )
| A. | KMnO4=K++Mn7++4O2- | B. | Ba(OH)2═Ba2++(OH-)2 | ||
| C. | Mg(NO3)2=Mg+2+2NO3- | D. | NaHCO3═Na++HCO3- |
16.根据如表数据,下列选项正确的是( )
| 化学式 | CH3COOH | H2SO3 | NH3•H2O |
| 电离常数K(25℃) | Ka=1.8×10-5 | Ka1=1.23×10-2;Ka2=6.6×10-8 | Kb=1.8×10-5 |
| A. | Na2SO3溶液中滴加足量醋酸,反应的离子方程式为:SO32-+2CH3COOH=SO2↑+H2O+2CH3COO- | |
| B. | 25℃时,pH=3的醋酸和pH=11的氨水等体积混合后,混合液中水的电离被促进 | |
| C. | NaHSO3溶液呈酸性,是因为Kw/Ka1>Ka2 | |
| D. | 0.1mol/L的CH3COOH溶液与等浓度等体积的CH3COONa混合后,溶液中的微粒存在以下关系:c(H+)+c(CH3COOH)=c(CH3COO-)+c(OH-) |
14.已知一定温度下合成氨反应:N2+H2═2NH3 (每生成2mol NH3放出92.4kJ的热量),在恒温恒压的密闭容器中进行如下实验:①通入1mol N2和3mol H2,达平衡时放出热量为Q1,②通入2mol N2和6mol H2,达平衡时放出热量为Q2,则下列关系正确的是( )
| A. | Q2>2 Q1 | B. | Q1=92.4 kJ | C. | Q1<Q2<184.8 kJ | D. | Q1=Q2<92.4 kJ |