题目内容
15.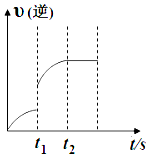 已知反应:C(s)+H2O(g)?CO(g)+H2(g)△H>0,某温度下,向5L密闭容器中加入2mol C(s)与1mol H2O(g),t1s时,CO的物质的量为0.20mol,到第t2s时恰好达到平衡,此时CO的物质的量为0.35mol,下列说法正确的是( )
已知反应:C(s)+H2O(g)?CO(g)+H2(g)△H>0,某温度下,向5L密闭容器中加入2mol C(s)与1mol H2O(g),t1s时,CO的物质的量为0.20mol,到第t2s时恰好达到平衡,此时CO的物质的量为0.35mol,下列说法正确的是( )| A. | t1时改变的条件可能是使用催化剂 | |
| B. | t1时改变的条件可能是增大 H2O 浓度 | |
| C. | t1~t2这段时间内的化学反应速率 v(H2O)=$\frac{{t}_{2}-{t}_{1}}{0.15}$ | |
| D. | t2后继续加入 2 mol C(s)平衡向正反应方向移动 |
分析 A.催化剂对平衡移动无影响;
B.增大 H2O 浓度,平衡正向移动,则CO的物质的量增大;
C.结合v=$\frac{△c}{△t}$计算;
D.C为固体,不影响平衡移动.
解答 解:A.催化剂对平衡移动无影响,则t1时改变的条件不可能是使用催化剂,故A错误;
B.增大 H2O 浓度,平衡正向移动,则CO的物质的量增大,则t1时改变的条件可能是增大 H2O 浓度,故B正确;
C.t1s时,CO的物质的量为0.20mol,到第t2s时恰好达到平衡,此时CO的物质的量为0.35mol,生成CO为0.15mol,则消耗的水为0.15mol,由v=$\frac{△c}{△t}$可知,t1~t2这段时间内的化学反应速率 v(H2O)=$\frac{\frac{0.15mol}{5L}}{{(t}_{2}-{t}_{1})s}$=$\frac{0.03}{{t}_{2}-{t}_{1}}$mol/(L.s),故C错误;
D.C为固体,不影响平衡移动,则t2后继续加入 2 mol C(s)平衡不移动,故D错误;
故选B.
点评 本题考查化学平衡的移动,为高频考点,把握浓度、催化剂对平衡的影响为解答的关键,侧重分析与应用能力的考查,注意习题中的信息判断平衡正向移动,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
8.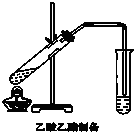 (1)为了检验和除去表中的各种杂质(括号里的为杂质),请从①中选出适当的检验试剂,从②中选出适当的除杂试剂,将所选的答案用字母填入相应的空格内.
(1)为了检验和除去表中的各种杂质(括号里的为杂质),请从①中选出适当的检验试剂,从②中选出适当的除杂试剂,将所选的答案用字母填入相应的空格内.
①检验的试剂:A.无水硫酸铜B.酸性高锰酸钾溶C.水D.氢氧化钠溶液
②除杂试剂:a.无水硫酸铜 b.乙酸 c.新制的生石灰 d.溴水
(2)如图,在左试管中先加入2mL 95%的乙醇,并在摇动下缓缓加入3mL浓硫酸,再加入2mL乙酸,充分摇匀.按图连接好装置,用酒精灯对左试管小火加热3~5min后,改用大火加热,当观察到右试管中有明显现象时停止实验.
试回答:在右试管中通常加入饱和碳酸钠溶液.作用是:中和挥发出来的乙酸,溶解挥发出来的乙醇,降低乙酸乙酯在水中的溶解度,便于分层得到乙酸乙酯;
反应中加入浓硫酸的作用是催化剂、吸水剂.
 (1)为了检验和除去表中的各种杂质(括号里的为杂质),请从①中选出适当的检验试剂,从②中选出适当的除杂试剂,将所选的答案用字母填入相应的空格内.
(1)为了检验和除去表中的各种杂质(括号里的为杂质),请从①中选出适当的检验试剂,从②中选出适当的除杂试剂,将所选的答案用字母填入相应的空格内.①检验的试剂:A.无水硫酸铜B.酸性高锰酸钾溶C.水D.氢氧化钠溶液
②除杂试剂:a.无水硫酸铜 b.乙酸 c.新制的生石灰 d.溴水
| 物质 | 检验试剂 | 除杂试剂 |
| 甲烷(乙烯) | ||
| 酒精(水) |
试回答:在右试管中通常加入饱和碳酸钠溶液.作用是:中和挥发出来的乙酸,溶解挥发出来的乙醇,降低乙酸乙酯在水中的溶解度,便于分层得到乙酸乙酯;
反应中加入浓硫酸的作用是催化剂、吸水剂.
3.下列物质中,属于电解质的是( )
| A. | CO2 | B. | HCl | C. | BaSO4 | D. | NaOH溶液 |
20.下列有关CuSO4•5H2O的叙述正确的是( )
| A. | 1 mol CuSO4•5H2O的质量为250g/mol | |
| B. | 125g CuSO4•5H2O的物质的量为0.5 mol | |
| C. | CuSO4•5H2O的摩尔质量为250g | |
| D. | 配制100mL 0.1mol/L 硫酸铜溶液需要CuSO4•5H2O 1.6g |
4.已知常温下,在溶液中发生如下反应:
①16H++10Z-+2XO4-═2X2++5Z2+8H2O
②2A2++B2═2A3++2B-
③2B-+Z2═B2+2Z-
由此推断下列说法错误的是( )
①16H++10Z-+2XO4-═2X2++5Z2+8H2O
②2A2++B2═2A3++2B-
③2B-+Z2═B2+2Z-
由此推断下列说法错误的是( )
| A. | 反应Z2+2A2+═2A3++2Z-可以进行 | |
| B. | Z元素在反应③中被还原,在反应①中被氧化 | |
| C. | 氧化性由强到弱的顺序是XO4-、Z2、B2、A3+ | |
| D. | 还原性由强到弱的顺序是Z-、B-、A2+、X2+ |
2. pH=2的A、B两种酸溶液各1mL,分别加水稀释到1000mL,其中pH与溶液体积V的关系如图所示.下列说法正确的是( )
pH=2的A、B两种酸溶液各1mL,分别加水稀释到1000mL,其中pH与溶液体积V的关系如图所示.下列说法正确的是( )
 pH=2的A、B两种酸溶液各1mL,分别加水稀释到1000mL,其中pH与溶液体积V的关系如图所示.下列说法正确的是( )
pH=2的A、B两种酸溶液各1mL,分别加水稀释到1000mL,其中pH与溶液体积V的关系如图所示.下列说法正确的是( )| A. | A、B两酸溶液的物质的量浓度一定相等 | |
| B. | 稀释后,A酸溶液的酸性比B酸溶液强 | |
| C. | a=5时,A是强酸,B是弱酸 | |
| D. | 若a小于5,则A、B都是弱酸,且A的酸性弱于B |
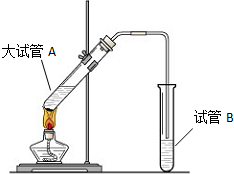 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题: