题目内容
18.一定条件下的密闭容器中:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-905.9kJ•mol-1,下列叙述正确的是( )| A. | 4molNH3和5molO2反应,达到平衡时放出热量为905.9kJ | |
| B. | 平衡时v正(O2)=v逆(NO) | |
| C. | 平衡后降低压强,混合气体平均摩尔质量增大 | |
| D. | 平衡后升高温度,混合气体中NO含量降低 |
分析 A.为可逆反应,不能完全转化;
B.平衡时,不同物质的正逆反应速率之比等于化学计量数之比;
C.该反应为气体体积增大的反应,则降低压强,平衡正向移动;
D.该反应为放热反应,升高温度,平衡逆向移动.
解答 解:A.为可逆反应,不能完全转化,则4molNH3和5molO2反应,达到平衡时放出热量小于905.9kJ,故A错误;
B.平衡时,不同物质的正逆反应速率之比等于化学计量数之比,则平衡时4v正(O2)=5v逆(NO),故B错误;
C.该反应为气体体积增大的反应,则降低压强,平衡正向移动,气体的物质的量增大,由M=$\frac{m}{n}$可知,混合气体平均摩尔质量减小,故C错误;
D.该反应为放热反应,升高温度,平衡逆向移动,则混合气体中NO含量降低,故D正确;
故选D.
点评 本题考查化学平衡的移动,为高频考点,把握温度和压强对平衡的影响、平衡特征为解答的关键,侧重分析与应用能力的考查,注意选项A为易错点,题目难度不大.

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案
相关题目
11.在高空中有一层臭氧层,它吸收了太阳光中绝大部分紫外线,使地球上的生物免收紫外线伤害.臭氧的化学式为O3,它是一种( )
| A. | 混合物 | B. | 单质 | C. | 氧化物 | D. | 化合物 |
13.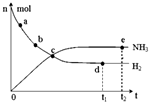 科学家一直致力于“人工固氮”的新方法研究.目前合成氨技术原理为:N2(g)+3H2(g)?2NH3(g).在673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
科学家一直致力于“人工固氮”的新方法研究.目前合成氨技术原理为:N2(g)+3H2(g)?2NH3(g).在673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
 科学家一直致力于“人工固氮”的新方法研究.目前合成氨技术原理为:N2(g)+3H2(g)?2NH3(g).在673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
科学家一直致力于“人工固氮”的新方法研究.目前合成氨技术原理为:N2(g)+3H2(g)?2NH3(g).在673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )| A. | 点a的正反应速率比点b的大 | |
| B. | 点c处反应达到化学平衡状态 | |
| C. | 点d和点e处的n(N2)不相同 | |
| D. | 点e反应达到化学平衡状态,反应停止 |
3.下列物质中,属于电解质的是( )
| A. | CO2 | B. | HCl | C. | BaSO4 | D. | NaOH溶液 |
7.下列离子方程式不正确的是( )
| A. | 将铜片放入稀硫酸中:Cu+2H+═Cu2++H2↑ | |
| B. | 将铁粉放入氯化铜溶液中:Fe+Cu2+═Fe2++Cu | |
| C. | Ba(OH)2溶液中滴入MgCl2溶液中:2OH-+Mg2+═Mg(OH)2↓ | |
| D. | 纯碱中滴加盐酸:CO32-+2H+═H2O+CO2↑ |
 用二氧化氯(ClO2)、高铁酸钠(Na2FeO4)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术.ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+.
用二氧化氯(ClO2)、高铁酸钠(Na2FeO4)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术.ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+.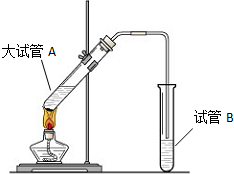 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题: