题目内容
19.下列物质在水溶液中的电离方程式书写完全正确的是( )| A. | KMnO4=K++Mn7++4O2- | B. | Ba(OH)2═Ba2++(OH-)2 | ||
| C. | Mg(NO3)2=Mg+2+2NO3- | D. | NaHCO3═Na++HCO3- |
分析 先判断电解质,强电解质用“═”,弱电解质用“?”,并遵循电荷守恒、质量守恒定律,注意原子团不能拆分,以此来解答.
解答 解:A.高锰酸钾完全电离生成钾离子和高锰酸根离子,电离方程式为KMnO4=K++MnO4-,故A错误;
B.氢氧化钡是强电解质,完全电离生成钡离子和氢氧根离子,电离方程式为Ba(OH)2═Ba2++2OH-,故B错误;
C.硝酸镁是强电解质,完全电离生成镁离子和硝酸根离子,电离方程式为Mg(NO3)2=Mg2++2NO3-,故C错误;
D.碳酸氢钠是强电解质,完全电离生成钠离子和碳酸氢根离子,电离方程式为NaHCO3═Na++HCO3-,故D正确;
故选D.
点评 本题考查电离方程式的书写,题目难度不大,明确电解质的强弱、电离方程式的书写方法、原子团及离子符号等即可解答,试题旨在考查学生灵活运用基础知识解决实际问题的能力,注意碳酸氢钠电离方程式和硫酸氢钠电离方程式的书写区别.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
14.将 AgNO3、Ba(NO3)2、Na2SO4、NaCl 四种电解质按物质的量之比1:1:1:2加入足量蒸馏水中,然后用铂电极电解该混合物至不再有溶质离子参与反应时,则所得氧化产物与还原产物的质量比为( )
| A. | 71:2 | B. | 35.5:108 | C. | 108:35.5 | D. | 71:109 |
4.已知常温下,在溶液中发生如下反应:
①16H++10Z-+2XO4-═2X2++5Z2+8H2O
②2A2++B2═2A3++2B-
③2B-+Z2═B2+2Z-
由此推断下列说法错误的是( )
①16H++10Z-+2XO4-═2X2++5Z2+8H2O
②2A2++B2═2A3++2B-
③2B-+Z2═B2+2Z-
由此推断下列说法错误的是( )
| A. | 反应Z2+2A2+═2A3++2Z-可以进行 | |
| B. | Z元素在反应③中被还原,在反应①中被氧化 | |
| C. | 氧化性由强到弱的顺序是XO4-、Z2、B2、A3+ | |
| D. | 还原性由强到弱的顺序是Z-、B-、A2+、X2+ |
11.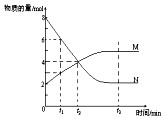 在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )
 在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )| A. | 反应的化学方程式为:N═2M | |
| B. | t2时,反应物和生成物的浓度相等,达到平衡 | |
| C. | 当M、N都是气体时增大压强,N物质的量减少 | |
| D. | 升高温度,平衡常数K增大,则反应的△H<0 |
7.下列离子方程式不正确的是( )
| A. | 将铜片放入稀硫酸中:Cu+2H+═Cu2++H2↑ | |
| B. | 将铁粉放入氯化铜溶液中:Fe+Cu2+═Fe2++Cu | |
| C. | Ba(OH)2溶液中滴入MgCl2溶液中:2OH-+Mg2+═Mg(OH)2↓ | |
| D. | 纯碱中滴加盐酸:CO32-+2H+═H2O+CO2↑ |
 用二氧化氯(ClO2)、高铁酸钠(Na2FeO4)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术.ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+.
用二氧化氯(ClO2)、高铁酸钠(Na2FeO4)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术.ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+.