题目内容
7.如图为实验室制取并收集氯气的装置图.请回答下列问题: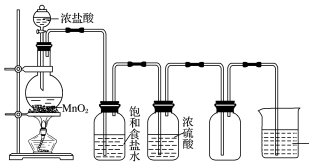
(1)实验室制取氯气的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)烧杯中盛放的液体是氢氧化钠,其作用是吸收Cl2,防止污染空气.
(3)8.7g MnO2与足量的浓盐酸充分反应,则被氧化的HCl的物质的量为0.2mol,生成的氯气在标准状况下的体积为2.24L.
分析 (1)二氧化锰与浓盐酸在加热条件下反应生成氯气、氯化锰和水;
(2)氯气有毒,需要用氢氧化钠溶液吸收;
(3)n(MnO2)=$\frac{8.7g}{87g/mol}$=0.1mol,二氧化锰与足量的浓盐酸反应:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,在反应中,盐酸不全部被氧化,部分表现为酸性,结合反应的化学方程式计算.
解答 解:(1)二氧化锰与浓盐酸在加热条件下反应生成氯气、氯化锰和水,化学方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;(1)MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑
(2)氯气有毒,需要进行尾气吸收,氯气能够与氢氧化钠溶液反应,可用氢氧化钠溶液吸收氯气,反应的离子方程式为:2OH-+Cl2=Cl-+ClO-+H2O,
故答案为:氢氧化钠;吸收Cl2,防止污染空气;
(3)n(MnO2)=$\frac{8.7g}{87g/mol}$=0.1mol,设生成氯气的体积为V,则
MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
1mol 22.4L
0.1mol V
V=$\frac{22.4L×0.1mol}{1mol}$=2.24L,
根据化合价的变化可知,在MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O反应中,当有4molHCl参加反应时,有2molHCl被氧化,则
MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O 被氧化的HCl
1mol 2mol
0.1mol 0.2mol
故答案为:0.2mol;2.24L.
点评 本题考查氯气的性质和氧化还原反应的计算,题目难度不大,注意根据反应的化学方程式计算,本题中要特别注意参加反应的盐酸与被氧化的盐酸的物质的量的关系.

| A. | Na+ | B. | Mg2+ | C. | HCl | D. | HF |
| A. | 体积相同、浓度均为0.1 mol•L-1的NaOH溶液、氨水,分别稀释m倍、n倍,溶液的pH都变成9,则m<n | |
| B. | 有甲、乙两氨水溶液,测得甲的pH=a,乙的pH=a+1,则甲乙两溶液c(H+)之比为10:1 | |
| C. | 相同温度下,0.2 mol•L-1乙酸溶液与0.1 mol•L-1乙酸溶液中c(H+)之比为2:1 | |
| D. | 已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为α,K=$\frac{c{α}^{2}}{c(1-α)}$.若加入少量醋酸钠固体,则CH3COOH?CH3COO-+H+向左移动,α减小,K变小 |
| A. | 此沉淀是Mg(OH)2、Ca(OH)2的混合物 | |
| B. | 此沉淀只有Mg(OH)2 | |
| C. | 过滤后滤液中存在Ca2+、Mg2+ | |
| D. | 向原溶液中加入8.8 g NaOH固体,不可以使Ca2+部分转化为沉淀 |