题目内容
15.跟氨分子所含的质子总数和电子总数都相同的粒子是( )| A. | Na+ | B. | Mg2+ | C. | HCl | D. | HF |
分析 氨分子所含的质子总数和电子总数均为7+1×3=10,结合微粒的质子数、电荷判断电子数,以此来解答.
解答 解:氨分子所含的质子总数和电子总数均为7+1×3=10,
A.Na+的质子数为11,电子数为11-1=10,故A不选;
B.Mg2+的质子数为12,电子数为12-2=10,故B不选;
C.HCl的质子数为1+17=18,电子数为18,故C不选;
D.HF的质子数为1+9=10,电子数为10,故D选;
故选D.
点评 本题考查原子的结构,为高频考点,把握原子的质子数、微粒电子数为解答的关键,侧重分析与计算能力的考查,注意分子中质子数等于电子数,题目难度不大.

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目
6.某食用白醋是由醋酸与纯水配制而成,用0.1000mol/L NaOH溶液准确测定其中醋酸的物质的量浓度.以下为某同学列出的实验步骤(未排序),请回答下列问题.
A.分别向碱式滴定管、酸式滴定管注入NaOH标准溶液和待测醋酸至0刻度以上2~3cm
B.调节滴定管液面至0或0刻度以下,记下读数
C.用NaOH标准溶液滴定至终点,记下滴定管液面的刻度
D.用标准溶液清洗碱式滴定管2~3次;待测醋酸清洗酸式滴定管2~3次
E.用待测醋酸清洗锥形瓶2~3次
F.排气泡使滴定管尖嘴充满溶液,把滴定管固定好
G.滴定管检漏,用水清洗所有仪器,备用
H.通过酸式滴定管向锥形瓶注入20.00mL待测醋酸,并加入2-3滴指示剂
(1)用离子方程式表示该实验的原理CH3COOH+OH-=CH3COO-+H2O.
(2)从上述实验步骤中选出正确的并按操作先后排序.你的实验顺序为:(用字母表示)G→D→A→F→B→H→C.
(3)实验室常用的酸碱指示剂有甲基橙、石蕊和酚酞,你选择的指示剂是酚酞,理由是两者恰好完全中和生成醋酸钠,其水溶液呈碱性,必需选择在碱性范围变色且颜色容易判断的酚酞作指示剂判断滴定终点;滴定终点的现象是当滴加最后一滴氢氧化钠溶液时,溶液变为浅红色且30s不褪色.
(4)某同学实验后得到的数据如下:
原白醋中醋酸的物质的量浓度为0.07500mol/L(结果保留4位有效数字).
(5)分析下列操作对测定结果的影响,用“偏低”、“偏高”或“不影响”填空.
①滴定前碱式滴定管充满溶液,滴定后尖嘴处有气泡偏低;
②读取标准溶液体积时,滴定前平视,滴定后仰视偏高.
A.分别向碱式滴定管、酸式滴定管注入NaOH标准溶液和待测醋酸至0刻度以上2~3cm
B.调节滴定管液面至0或0刻度以下,记下读数
C.用NaOH标准溶液滴定至终点,记下滴定管液面的刻度
D.用标准溶液清洗碱式滴定管2~3次;待测醋酸清洗酸式滴定管2~3次
E.用待测醋酸清洗锥形瓶2~3次
F.排气泡使滴定管尖嘴充满溶液,把滴定管固定好
G.滴定管检漏,用水清洗所有仪器,备用
H.通过酸式滴定管向锥形瓶注入20.00mL待测醋酸,并加入2-3滴指示剂
(1)用离子方程式表示该实验的原理CH3COOH+OH-=CH3COO-+H2O.
(2)从上述实验步骤中选出正确的并按操作先后排序.你的实验顺序为:(用字母表示)G→D→A→F→B→H→C.
(3)实验室常用的酸碱指示剂有甲基橙、石蕊和酚酞,你选择的指示剂是酚酞,理由是两者恰好完全中和生成醋酸钠,其水溶液呈碱性,必需选择在碱性范围变色且颜色容易判断的酚酞作指示剂判断滴定终点;滴定终点的现象是当滴加最后一滴氢氧化钠溶液时,溶液变为浅红色且30s不褪色.
(4)某同学实验后得到的数据如下:
| 滴定次数 实验数据 | 1 | 2 | 3 | 4 | 5 |
| V(NaOH)/mL(初读数) | 0.00 | 0.20 | 0.00 | 0.10 | 0.05 |
| V(NaOH)/mL(终读数) | 15.75 | 15.20 | 14.98 | 15.12 | 15.05 |
(5)分析下列操作对测定结果的影响,用“偏低”、“偏高”或“不影响”填空.
①滴定前碱式滴定管充满溶液,滴定后尖嘴处有气泡偏低;
②读取标准溶液体积时,滴定前平视,滴定后仰视偏高.
3.下列实验中不能观察到明显现象的是( )
| A. | 少量的氯水加入到盛有NaBr溶液的试管中 | |
| B. | 取一小片铝,砂纸除去氧化膜,放入试管中,加入少量2mL水 | |
| C. | 将锌片与铜片用导线连接,插入盛稀硫酸的烧杯中 | |
| D. | 向盛有过氧化氢水溶液的试管中,加入少量1mol/LFeCl3溶液 |
10.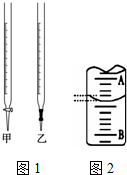 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①取一支图1所示仪器,用蒸馏水洗净,即加入待测的NaOH溶液,
使尖嘴部分充满溶液,并调整液面处于“0“刻度以下的位置,记下读数;
②取锥形瓶用蒸馏水洗净,精确量取一定量的0.1000mol•L-1标准盐酸;
③加入3滴酚酞试液,摇匀;
④进行滴定实验,并记录数据.
⑤重复以上步骤2次.
回答下列问题:
(1)步骤①中应将NaOH溶液注入图中的碱式滴定管(填仪器名称)中.
(2)在步骤①中存在的明显错误是滴定管没有用待测NaOH溶液润洗,由此会使测定结果偏低(选填“偏高”、“偏低”或“无影响”).
(3)图2是某次实验中液面位置示意图,若A与B刻度间相差1mL,A处的刻度为19,滴定管中液面读数应为19.40mL.
(4)操作④中左手轻轻挤压玻璃球,右手振荡锥形瓶,眼睛注视锥形瓶内溶液颜色的变化,能确定实验终点的现象是加入最后一滴液体,溶液由无色变成浅红色,且半分钟内不褪色.
(5)根据下列数据:
计算待测烧碱溶液的浓度为0.1053 mol/L(保留至小数点后四位).
 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:①取一支图1所示仪器,用蒸馏水洗净,即加入待测的NaOH溶液,
使尖嘴部分充满溶液,并调整液面处于“0“刻度以下的位置,记下读数;
②取锥形瓶用蒸馏水洗净,精确量取一定量的0.1000mol•L-1标准盐酸;
③加入3滴酚酞试液,摇匀;
④进行滴定实验,并记录数据.
⑤重复以上步骤2次.
回答下列问题:
(1)步骤①中应将NaOH溶液注入图中的碱式滴定管(填仪器名称)中.
(2)在步骤①中存在的明显错误是滴定管没有用待测NaOH溶液润洗,由此会使测定结果偏低(选填“偏高”、“偏低”或“无影响”).
(3)图2是某次实验中液面位置示意图,若A与B刻度间相差1mL,A处的刻度为19,滴定管中液面读数应为19.40mL.
(4)操作④中左手轻轻挤压玻璃球,右手振荡锥形瓶,眼睛注视锥形瓶内溶液颜色的变化,能确定实验终点的现象是加入最后一滴液体,溶液由无色变成浅红色,且半分钟内不褪色.
(5)根据下列数据:
| 滴定次数 | 标准盐酸体积/mL | 待测液体积/mL | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.52 | 19.42 |
| 第二次 | 20.00 | 4.07 | 23.17 |
| 第三次 | 20.00 | 1.08 | 20.08 |
 充电宝基本都由聚合物锂电池作为储电单元,它本身就是一个聚合物锂电池的储电装置,通过IC芯片进行电压的调控,再通过连接电源线充电或储电后将贮存的电量释放出来.
充电宝基本都由聚合物锂电池作为储电单元,它本身就是一个聚合物锂电池的储电装置,通过IC芯片进行电压的调控,再通过连接电源线充电或储电后将贮存的电量释放出来. 在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,混合气体的颜色变深.
在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,混合气体的颜色变深.