题目内容
7.下列有关实验原理或实验操作正确的是( )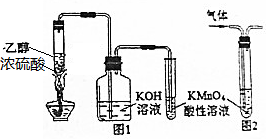
| A. | 用图1所示装置制取乙烯并验证其某些性质 | |
| B. | 用图2装置除去甲烷中的乙烯 | |
| C. | 在坩埚中灼烧CuSO4•5H2O晶体以除去结晶水 | |
| D. | 0.5g淀粉、5mL20%H2SO4和5mL蒸馏水混合,加热5min后冷却,然后向其中加入新制银氨溶液,水浴加热,无银镜反应,说明淀粉没有水解 |
分析 A.乙醇必须在浓硫酸作催化剂条件下才能发生消去反应生成乙烯,且需要170℃;
B.乙烯能被酸性高锰酸钾溶液氧化生成二氧化碳;
C.灼烧药品需要在坩埚中进行;
D.银镜反应必须在碱性条件下进行.
解答 解:A.乙醇必须在浓硫酸作催化剂条件下才能发生消去反应生成乙烯,且需要170℃,没有温度计,不能实现实验目的,故A错误;
B.乙烯能被酸性高锰酸钾溶液氧化生成二氧化碳,能引进新的杂质,可以用溴水除去甲烷中的乙烯,故B错误;
C.灼烧药品需要在坩埚中进行,该实验能实现实验目的,故C正确;
D.银镜反应必须在碱性条件下进行,在加入银氨溶液之前必须加入NaOH溶液,防止银氨溶液和稀硫酸反应,故D错误;
故选C.
点评 本题考查化学实验方案评价,为高频考点,涉及银镜反应、仪器选取、除杂、气体制备等知识点,明确实验原理、物质性质及实验操作是解本题关键,侧重实验操作、实验评价能力,易错选项是BD.

练习册系列答案
相关题目
18.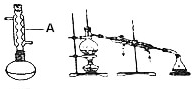 苯佐卡因(对氨基甲酸乙酯)常用于创面、溃疡面及痔疮的止痛,也是镇咳药退咳药的中间体,有关数据和实验装置图如下:
苯佐卡因(对氨基甲酸乙酯)常用于创面、溃疡面及痔疮的止痛,也是镇咳药退咳药的中间体,有关数据和实验装置图如下:
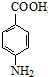 +CH3CH2OH$→_{△}^{浓硫酸}$
+CH3CH2OH$→_{△}^{浓硫酸}$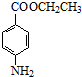 +H2O.
+H2O.
合成反应:
在圆底烧瓶中加入0.4g(0.0029mol)对氨基苯甲酸和0.082mol乙醇,振荡溶解,将烧瓶置于冰水浴并加入0.22mL浓硫酸(0.004mol),将反应混合物在水浴上加热回流1h,并不时振荡.
分离提纯:
冷却后,分批加入10%的NaHCO3溶液直至无明显气泡产生,再加少量NaCHO3溶液至pH≈9,转移至分液漏斗中,用乙醚分两次萃取,并向乙醚层加入无水硫酸钠,得到乙醚层,冷却结晶,最终得到产物0.2g.
(1)仪器A的名称:球形冷凝管,烧瓶置于水浴中的原因反应温度低于水的沸点,受热均匀,偏于控制温度,.
(2)加热前还需在烧瓶中加入碎瓷片.
(3)在合成反应中,圆底烧瓶的容积最合适的是A
A.10mL B.20mL C.50mL
(4)分液漏斗使用前必须进行的操作是查漏,乙醚层位于上层(填“上层”或“下层”);分离提纯操作加入无水硫酸钠的作用是吸收乙醚中的水.
(5)合成反应中加入过量乙醇的目的是提高对氨基苯甲酸的利用率;分离提纯过程中10%NaHCO3溶液的作用是除去混有对氨基苯甲酸.
(6)本实验中苯佐卡因的产率为41.8%(结果保留三位有效数字)
 苯佐卡因(对氨基甲酸乙酯)常用于创面、溃疡面及痔疮的止痛,也是镇咳药退咳药的中间体,有关数据和实验装置图如下:
苯佐卡因(对氨基甲酸乙酯)常用于创面、溃疡面及痔疮的止痛,也是镇咳药退咳药的中间体,有关数据和实验装置图如下: +CH3CH2OH$→_{△}^{浓硫酸}$
+CH3CH2OH$→_{△}^{浓硫酸}$ +H2O.
+H2O.| 相对分子质量 | 密度/(g•cm-3) | 熔点/℃ | 沸点/℃ | 水中溶解性 | |
| 乙醇 | 46 | 0.789 | -117.3 | 78.5 | 与水任意比互溶 |
| 对氨基苯甲酸 | 137 | 1.374 | 188 | 339.9 | 微溶于水 |
| 对氨基苯甲酸乙酯 | 165 | 1.039 | 90 | 172 | 难溶于水,易溶于醇、醛类 |
在圆底烧瓶中加入0.4g(0.0029mol)对氨基苯甲酸和0.082mol乙醇,振荡溶解,将烧瓶置于冰水浴并加入0.22mL浓硫酸(0.004mol),将反应混合物在水浴上加热回流1h,并不时振荡.
分离提纯:
冷却后,分批加入10%的NaHCO3溶液直至无明显气泡产生,再加少量NaCHO3溶液至pH≈9,转移至分液漏斗中,用乙醚分两次萃取,并向乙醚层加入无水硫酸钠,得到乙醚层,冷却结晶,最终得到产物0.2g.
(1)仪器A的名称:球形冷凝管,烧瓶置于水浴中的原因反应温度低于水的沸点,受热均匀,偏于控制温度,.
(2)加热前还需在烧瓶中加入碎瓷片.
(3)在合成反应中,圆底烧瓶的容积最合适的是A
A.10mL B.20mL C.50mL
(4)分液漏斗使用前必须进行的操作是查漏,乙醚层位于上层(填“上层”或“下层”);分离提纯操作加入无水硫酸钠的作用是吸收乙醚中的水.
(5)合成反应中加入过量乙醇的目的是提高对氨基苯甲酸的利用率;分离提纯过程中10%NaHCO3溶液的作用是除去混有对氨基苯甲酸.
(6)本实验中苯佐卡因的产率为41.8%(结果保留三位有效数字)
2.下列生活常识与化学原理有关,其中说法错误的是( )
| A. | 加工后具有吸水性的植物纤维可用作食品干燥剂 | |
| B. | 服用阿司匹林出现水杨酸反应时,用NaHCO3溶液解毒 | |
| C. | 明矾水解形成氢氧化铝胶体能杀菌消毒,可用水的净化 | |
| D. | 硫酸亚铁补铁剂应与维生素C同服,是因为维生素C可以防止Fe2+被氧化 |
2.(1)已知Na2S2O3+H2SO4═Na2SO4+S↓+SO2+H2O.甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响.设计实验如表(所取溶液体积均为10mL):
其他条件不变时:探究浓度对化学反应速率的影响,应选择①②或③④.(填实验编号);探究温度对化学反应速率的影响,应选择①④.(填实验编号).
(2)甲同学设计如图实验流程探究Na2S2O3的化学性质.
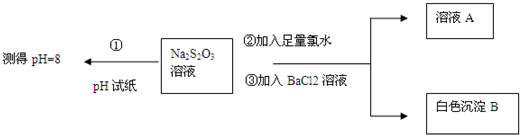
(Ⅰ)甲同学设计实验流程的目的是证明Na2S2O3溶液具有碱性和还原 性.
(Ⅱ)生成白色沉淀B的离子方程式是SO42-+Ba2+=BaSO4↓.
(Ⅲ)已知Na2S2O3溶液与Cl2反应时,1mol Na2S2O3转移8mol电子.该反应的离子方程式是S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+.
| 实验编号 | 实验温度/℃ | c(Na2S2O3)/mol•L-1 | c(H2SO4)/mol•L-1 |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.1 | 0.2 |
| ③ | 50 | 0.2 | 0.1 |
| ④ | 50 | 0.1 | 0.1 |
(2)甲同学设计如图实验流程探究Na2S2O3的化学性质.

(Ⅰ)甲同学设计实验流程的目的是证明Na2S2O3溶液具有碱性和还原 性.
(Ⅱ)生成白色沉淀B的离子方程式是SO42-+Ba2+=BaSO4↓.
(Ⅲ)已知Na2S2O3溶液与Cl2反应时,1mol Na2S2O3转移8mol电子.该反应的离子方程式是S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+.
9.对将待测液置于锥形瓶的滴定实验,下列错误操作中,能造成中和滴定结果偏低的是( )
| A. | 未用标准液润洗滴定管 | |
| B. | 盛标准液的滴定管尖嘴部分有气泡未排除就开始滴定 | |
| C. | 往锥形瓶中加待测液时,锥形瓶中有少许水 | |
| D. | 振荡时锥形瓶中液滴飞溅出来 |
6.下列物质中,属于纯净物的是( )
| A. | 氧化铁 | B. | 铝热剂 | C. | 玻璃 | D. | 钢 |
7.下列说法不正确的是( )
| A. | 明矾可做消毒剂 | |
| B. | 铝制品抛光车间须严格控制粉尘浓度以防爆炸 | |
| C. | 氧化铝可作耐火材料 | |
| D. | 金属铝无需经过特别处理就具有抗腐蚀能力 |