题目内容
18.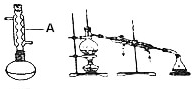 苯佐卡因(对氨基甲酸乙酯)常用于创面、溃疡面及痔疮的止痛,也是镇咳药退咳药的中间体,有关数据和实验装置图如下:
苯佐卡因(对氨基甲酸乙酯)常用于创面、溃疡面及痔疮的止痛,也是镇咳药退咳药的中间体,有关数据和实验装置图如下: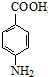 +CH3CH2OH$→_{△}^{浓硫酸}$
+CH3CH2OH$→_{△}^{浓硫酸}$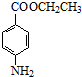 +H2O.
+H2O.| 相对分子质量 | 密度/(g•cm-3) | 熔点/℃ | 沸点/℃ | 水中溶解性 | |
| 乙醇 | 46 | 0.789 | -117.3 | 78.5 | 与水任意比互溶 |
| 对氨基苯甲酸 | 137 | 1.374 | 188 | 339.9 | 微溶于水 |
| 对氨基苯甲酸乙酯 | 165 | 1.039 | 90 | 172 | 难溶于水,易溶于醇、醛类 |
在圆底烧瓶中加入0.4g(0.0029mol)对氨基苯甲酸和0.082mol乙醇,振荡溶解,将烧瓶置于冰水浴并加入0.22mL浓硫酸(0.004mol),将反应混合物在水浴上加热回流1h,并不时振荡.
分离提纯:
冷却后,分批加入10%的NaHCO3溶液直至无明显气泡产生,再加少量NaCHO3溶液至pH≈9,转移至分液漏斗中,用乙醚分两次萃取,并向乙醚层加入无水硫酸钠,得到乙醚层,冷却结晶,最终得到产物0.2g.
(1)仪器A的名称:球形冷凝管,烧瓶置于水浴中的原因反应温度低于水的沸点,受热均匀,偏于控制温度,.
(2)加热前还需在烧瓶中加入碎瓷片.
(3)在合成反应中,圆底烧瓶的容积最合适的是A
A.10mL B.20mL C.50mL
(4)分液漏斗使用前必须进行的操作是查漏,乙醚层位于上层(填“上层”或“下层”);分离提纯操作加入无水硫酸钠的作用是吸收乙醚中的水.
(5)合成反应中加入过量乙醇的目的是提高对氨基苯甲酸的利用率;分离提纯过程中10%NaHCO3溶液的作用是除去混有对氨基苯甲酸.
(6)本实验中苯佐卡因的产率为41.8%(结果保留三位有效数字)
分析 (1)由仪器的结构特征,可知A为球形冷凝管;烧瓶置于水浴中,受热均匀,偏于控制温度;
(2)液体加热,需要加热碎瓷片防止暴沸;
(3)液体量不超过容积的$\frac{2}{3}$,不少于容积的$\frac{1}{3}$;
(4)分液漏斗使用前必须进行查漏;乙醚的密度小于溶液密度;硫酸钠吸收乙醚中的水;
(5)加入过量乙醇,有利于平衡正向移动,可以提高对氨基苯甲酸的利用率;反应后有未反应的对氨基苯甲酸,需要除去;
(6)根据氨基苯甲酸计算苯佐卡因的理论产量,产率=$\frac{实际产量}{理论产量}$×100%.
解答 解:(1)由仪器的结构特征,可知A为球形冷凝管,烧瓶置于水浴中,说明反应温度低于水的沸点,受热均匀,偏于控制温度,
故答案为:球形冷凝管;反应温度低于水的沸点,受热均匀,偏于控制温度;
(2)液体加热,需要加热碎瓷片防止暴沸,
故答案为:碎瓷片;
(3)加入液体总体积为$\frac{0.082mol×46g/mol}{0.789g/mL}$+0.22mL≈5mL,液体量不超过容积的$\frac{2}{3}$,不少于容积的$\frac{1}{3}$,选择10mL的圆底烧瓶比较合适,
故选:A;
(4)分液漏斗使用前必须进行查漏,乙醚的密度小于溶液密度,分层后在上层,加入少量无水硫酸钠的目的是:吸收乙醚中的水,
故答案为:查漏;上层;吸收乙醚中的水;
(5)加入过量乙醇,有利于平衡正向移动,可以提高对氨基苯甲酸的利用率,
反应后有未反应的对氨基苯甲酸,加入NaHCO3溶液的作用是:除去混有对氨基苯甲酸,
故答案为:提高对氨基苯甲酸的利用率;除去混有对氨基苯甲酸;
(6)苯佐卡因的理论产量为0.0029mol×165g/mol=0.4785g,故产率=$\frac{0.2g}{0.4785g}$×100%=41.8%,
故答案为:41.8%.
点评 本题考查有机物的制备实验,涉及化学仪器识别与使用、物质的分离提纯、基本操作、产率计算等,是对制备实验的综合考查,难度不大.

| A. | X的常见氢化物水溶液显弱碱性 | |
| B. | 组成为HZO的物质结构式为H-Z-O | |
| C. | 最高价氧化物对应水化物酸性:Z>X>Y | |
| D. | 简单离子半径:Z>Y>X |
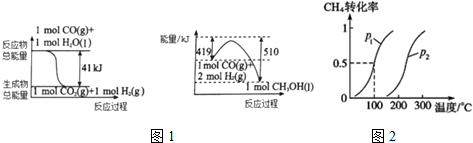
(1)利用工业废气CO2可制取甲醇,已知常温常压下下列反应的能量关系如图1:则CO2与H2反应生成液态CH3OH的热化学方程式为CO2(g)+3H2(g)=CH3OH(l)+H2O(l)△H=-50KJ/mol.
(2)CH4和H2O(g)通过下列转化也可以制得CH3OH:
I.CH4(g)+H2O(g)?CO(g)+3H2(g);△H1>0
Ⅱ.CO(g)+2H2(g)?CH3OH(g);△H2<0
将1.0molCH4和3.0molH2O(g)通入反应室(容积为100L)中,在一定条件下发生反应I,CH4的转化率与温度、压强的关系如图2所示.
①图中的p1<p2(填“<”、“>”或“=”),判断的理由是该反应正方向为体积增大的方向,相同温度下,压强越大甲烷的转化率减小,P2 的转化率比P1小,说明P2<P1.
②若反应Ⅱ在恒容密闭容器进行,下列能判断反应Ⅱ达到平衡状态的是cd(填序号).
a.生成CH3OH的速率与消耗CO的速率相等 b.混合气体的密度不变
c.混合气体的总物质的量不变 d.CH3OH、CO、H2的浓度都不再发生变化
③在某温度下,将一定量的CO和H2投入10L的密闭容器中发生反应II,5min时达到平衡,各物质的物质的浓度(mol•L-1)变化如下表所示:
| 2min | 5min | 10min | |
| CO | 0.07 | 0.06 | 0.05 |
| H2 | 0.14 | 0.12 | 0.20 |
| CH3OH | 0.03 | 0.04 | 0.05 |
| A. | 金属性逐渐增强 | |
| B. | 化合价逐渐升高 | |
| C. | 失电子能力逐渐减弱 | |
| D. | 最高价氧化物对应的水化物碱性逐渐减弱 |
①苯的间位二元取代物只有一种;②苯的邻位二元取代物只有一种;③苯不能使酸性KMnO4溶液褪色;④苯不能与溴水反应.
| A. | ①②③ | B. | ②③④ | C. | ①③④ | D. | 全部 |
| A. | 天津港爆炸案中对剧毒的氯化钠(NaCN)喷洒双氧水消毒,是利用了双氧水的氧化性 | |
| B. | 碳酸钙分解、氢氧化钡晶体和氧化铵固体反应,高温下铝与氧化铁反应都是吸热反应 | |
| C. | 镧镍合金能大量吸收H2形成金属氢化物,可作储氢材料 | |
| D. | 屠呦呦女士利用乙醚萃取青蒿素获得了2015年度诺贝尔生理学或医学奖,为人类防治疟疾作出了重大贡献 |
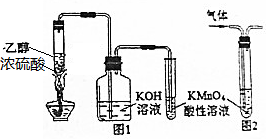
| A. | 用图1所示装置制取乙烯并验证其某些性质 | |
| B. | 用图2装置除去甲烷中的乙烯 | |
| C. | 在坩埚中灼烧CuSO4•5H2O晶体以除去结晶水 | |
| D. | 0.5g淀粉、5mL20%H2SO4和5mL蒸馏水混合,加热5min后冷却,然后向其中加入新制银氨溶液,水浴加热,无银镜反应,说明淀粉没有水解 |
| A. | CCl4 | B. | H2O | C. | He | D. | Al |