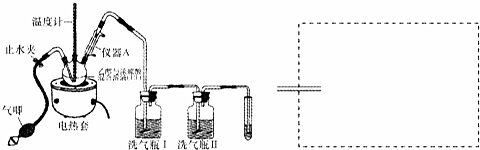
题目内容
7.下列说法不正确的是( )| A. | 明矾可做消毒剂 | |
| B. | 铝制品抛光车间须严格控制粉尘浓度以防爆炸 | |
| C. | 氧化铝可作耐火材料 | |
| D. | 金属铝无需经过特别处理就具有抗腐蚀能力 |
分析 A.明矾是硫酸铝钾,溶解后的溶液中铝离子水解生成氢氧化铝胶体,具有吸附悬浮杂质的作用;
B.粉尘表面积较大,易燃烧;
C.氧化铝熔点高;
D.铝是活泼金属,在空气中易与氧气发生反应生成氧化铝.
解答 解:A.明矾是硫酸铝钾,溶解后的溶液中铝离子水解生成氢氧化铝胶体,具有吸附悬浮杂质的作用,无氧化性不能消毒杀菌,故A错误;
B.粉尘表面积较大,遇到明火易发生爆炸须严格控制粉尘浓度,故B正确;
C.氧化铝熔点很高,氧化铝可作耐火材料,故C正确;
D.铝的表面易形成致密的氧化膜,氧化膜能饱和内部金属不被腐蚀,所以铝具有很强的抗腐蚀能力,故D正确;
故选A.
点评 本题考查了元素化合物的性质与用途,主要是铝及其化合物性质的应用,题目难度不大,注意把握常见物质的物理化学性质以及其用途,侧重于基础知识的考查.

练习册系列答案
相关题目
7.下列有关实验原理或实验操作正确的是( )
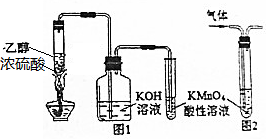

| A. | 用图1所示装置制取乙烯并验证其某些性质 | |
| B. | 用图2装置除去甲烷中的乙烯 | |
| C. | 在坩埚中灼烧CuSO4•5H2O晶体以除去结晶水 | |
| D. | 0.5g淀粉、5mL20%H2SO4和5mL蒸馏水混合,加热5min后冷却,然后向其中加入新制银氨溶液,水浴加热,无银镜反应,说明淀粉没有水解 |
18.下列微粒中各原子的最外层电子数均满足8电子的是( )
| A. | CCl4 | B. | H2O | C. | He | D. | Al |
2.下列反应中能量变化与其它三个不同的是( )
| A. | 铝热反应 | B. | 燃料燃烧 | ||
| C. | 酸碱中和反应 | D. | Ba(OH)2•8H2O与NH4Cl固体混合 |
12.下列说法正确的是( )
| A. | 等质量的铜粉按a、b两种途径完全转化,途径a和途径b消耗的H2SO4相等 途径a:Cu$→_{△}^{O_{2}}$CuO$\stackrel{稀H_{2}SO_{4}}{→}$CuSO4; 途径b:Cu$→_{△}^{浓H_{2}SO_{4}}$CuSO4 | |
| B. | Al2O3和MgO均可与NaOH溶液反应 | |
| C. | 78gNa2O2中存在的共价键总数为NA(NA为阿伏伽德罗常数的值) | |
| D. | 18gD2O中含有的质子数为10NA(NA为阿伏伽德罗常数的值) |
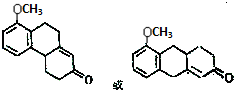
16.对于烃, 的命名正确的是( )
的命名正确的是( )
 的命名正确的是( )
的命名正确的是( )| A. | 2,4,4-三甲基戊烷 | B. | 2,4-二甲基戊烷 | ||
| C. | 2,2,4-三甲基戊烷 | D. | 4,4-二甲基己烷 |
17.以下实验能获得成功的是( )
| A. | 用酸性KMnO4溶液鉴别乙烯和乙炔 | |
| B. | 将铁屑、溴水、苯混合制成溴苯 | |
| C. | 蔗糖溶液加稀H2SO4加热后再加新制银氨溶液制银镜 | |
| D. | 将铜丝在酒精灯上加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色 |
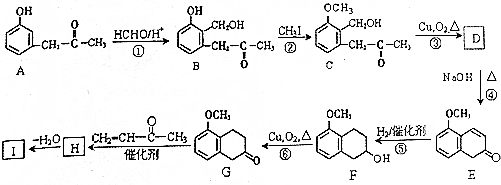
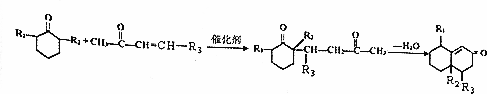
 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2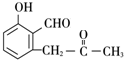 +2H2O.
+2H2O.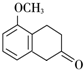 +
+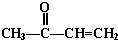 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$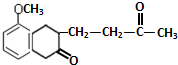 .
. .
.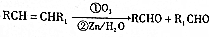 )
)