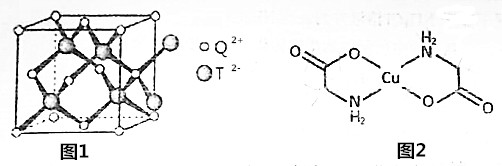
题目内容
2.下列生活常识与化学原理有关,其中说法错误的是( )| A. | 加工后具有吸水性的植物纤维可用作食品干燥剂 | |
| B. | 服用阿司匹林出现水杨酸反应时,用NaHCO3溶液解毒 | |
| C. | 明矾水解形成氢氧化铝胶体能杀菌消毒,可用水的净化 | |
| D. | 硫酸亚铁补铁剂应与维生素C同服,是因为维生素C可以防止Fe2+被氧化 |
分析 A.具有吸水性的植物纤维无毒;
B.水杨酸为邻羟基苯甲酸,含有羧基,羧基能与碳酸氢钠反应;
C.氢氧化铝胶体具有吸附作用,不能杀菌消毒;
D.维生素C具有还原性.
解答 解:A.具有吸水性的植物纤维无毒,则可用作食品干燥剂,故A正确;
B.水杨酸为邻羟基苯甲酸,含有羧基、酚羟基,羧基能与碳酸氢钠反应生成二氧化碳,服用阿司匹林出现水杨酸反应时,可以用NaHCO3溶液解毒,故B正确;
C.明矾水解形成氢氧化铝胶体,氢氧化铝胶体具有吸附作用,能吸附水中的悬浮颗粒,不能杀菌消毒,故C错误;
D.维生素C具有还原性,能被铁离子还原为亚铁离子,所以维生素C可以防止Fe2+被氧化,故D正确.
故选C.
点评 本题考查化学与生产、生活的关系,题目难度不大,要求学生能够用化学知识解释化学现象,试题培养了学生的分析、理解能力及灵活应用基础知识的能力.

练习册系列答案
相关题目
12.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 0.1mol Na2O2与足量的潮湿的二氧化碳反应转移的电子数为0.1NA | |
| B. | 1mol镁与足量O2或N2反应生成MgO或Mg3N2失去电子分别为2NA和3NA | |
| C. | 含NA个Na+的Na2O2溶于1L水中,Na+的物质的量浓度为1 mol/L | |
| D. | 某密闭容器中盛有0.2molN2和0.3molH2,在一定条件下充分反应,转移电子的数目为0.6 NA |
13.下列有关碱金属元素的性质从上到下递变规律正确的是( )
| A. | 金属性逐渐增强 | |
| B. | 化合价逐渐升高 | |
| C. | 失电子能力逐渐减弱 | |
| D. | 最高价氧化物对应的水化物碱性逐渐减弱 |
10.下列说法不正确的是( )
| A. | 天津港爆炸案中对剧毒的氯化钠(NaCN)喷洒双氧水消毒,是利用了双氧水的氧化性 | |
| B. | 碳酸钙分解、氢氧化钡晶体和氧化铵固体反应,高温下铝与氧化铁反应都是吸热反应 | |
| C. | 镧镍合金能大量吸收H2形成金属氢化物,可作储氢材料 | |
| D. | 屠呦呦女士利用乙醚萃取青蒿素获得了2015年度诺贝尔生理学或医学奖,为人类防治疟疾作出了重大贡献 |
7.下列有关实验原理或实验操作正确的是( )
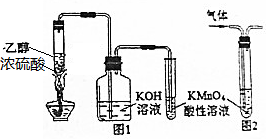

| A. | 用图1所示装置制取乙烯并验证其某些性质 | |
| B. | 用图2装置除去甲烷中的乙烯 | |
| C. | 在坩埚中灼烧CuSO4•5H2O晶体以除去结晶水 | |
| D. | 0.5g淀粉、5mL20%H2SO4和5mL蒸馏水混合,加热5min后冷却,然后向其中加入新制银氨溶液,水浴加热,无银镜反应,说明淀粉没有水解 |
4.草酸与高锰酸钾在酸性条件下能够发生如下反应:MnO4+H2C2O4+H+--Mn2++CO2↑+H2O(未配平)
用4mL0.001mol/LKMnO4溶液与2mL0.01mol/LH2C2O4溶液,研究不同条件对化学反应速率的影响.改变的条件如下:
(1)该反应中氧化剂和还原剂的物质的量之比为2:5.
(2)如果研究温度对化学反应速率的影响,使用实验Ⅰ、Ⅱ (用Ⅰ~Ⅳ表示,下同).
(3)对比实验Ⅰ和Ⅲ,可以研究浓度对化学反应速率的影响,实验Ⅳ中加入1mL蒸馏水的目的是确保溶液总体积不变.
(4)在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快.针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速度加快.从影响化学反应速率的因素看,你猜想反应速率明显加快的原因还可能是催化剂(或锰离子的催化作用)的影响.
A.2mL B.硫酸锰.
用4mL0.001mol/LKMnO4溶液与2mL0.01mol/LH2C2O4溶液,研究不同条件对化学反应速率的影响.改变的条件如下:
| 组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 2mL | 20 | / |
| Ⅱ | 2mL | 30 | / |
| Ⅲ | 1mL | 20 | 1mL蒸馏水 |
| Ⅳ | A | 20 | B |
(2)如果研究温度对化学反应速率的影响,使用实验Ⅰ、Ⅱ (用Ⅰ~Ⅳ表示,下同).
(3)对比实验Ⅰ和Ⅲ,可以研究浓度对化学反应速率的影响,实验Ⅳ中加入1mL蒸馏水的目的是确保溶液总体积不变.
(4)在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快.针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速度加快.从影响化学反应速率的因素看,你猜想反应速率明显加快的原因还可能是催化剂(或锰离子的催化作用)的影响.
A.2mL B.硫酸锰.
2.下列反应中能量变化与其它三个不同的是( )
| A. | 铝热反应 | B. | 燃料燃烧 | ||
| C. | 酸碱中和反应 | D. | Ba(OH)2•8H2O与NH4Cl固体混合 |
 .
.