题目内容
17.某研究性学习小组同学对由某均匀混合的NaHCO3和KHCO3样品进行实验,测得实验如下图所示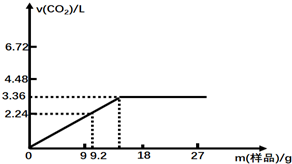
已知:Ⅰ.所测气体体积为标准状况
Ⅱ.盐酸的物质的量浓度相等,且体积均是50mL;试计算:
(1)盐酸的物质的量浓度3mol•L-1.
(2)混合物样品中,NaHCO3与KHCO3的物质的量之比1:1.
分析 (1)开始时发生反应的离子方程式为:HCO3-+H+=H2O+CO2↑,所以盐酸的物质的量与二氧化碳的物质的量相等,结合c=$\frac{n}{V}$计算求解;
(2)根据图示可知,当固体质量为9.2g时盐酸过量,碳酸氢钠和碳酸氢钾完全反应,根据固体质量和二氧化碳的量列出二元一次方程组进行计算.
解答 解:(1)开始时发生反应的离子方程式为:HCO3-+H+=H2O+CO2↑,所以盐酸的物质的量与二氧化碳的物质的量相等,所以50mL中盐酸有物质的是量为:$\frac{3.36}{22.4}$=0.15mol,结合c=$\frac{n}{V}$=$\frac{0.15}{0.05}$=3mol/L,故答案为:3;
(2)当固体质量为9.2g时盐酸过量,碳酸氢钠和碳酸氢钾完全反应,
设NaHCO3为的物质的量为xmol、KHCO3为ymol,
根据混合物质量可得:①84x+100y=9.2,
根据生成二氧化碳的物质的量,利用碳原子守恒可得:②x+y=$\frac{2.24L}{22.4L/mol}$=0.1,
根据①②解得:x=y=0.05,混合物样品中,NaHCO3与KHCO3的物质的量之比1:1,
故答案为:1:1.
点评 本题考查了有关混合物反应的计算,题目难度中等,正确分析图象中曲线变化的含义为解答关键,注意掌握质量分数的概念及表达式,试题侧重考查学生的分析、理解能力及化学计算能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
7.化学与生活、社会可持续发展密切相关.下列有关叙述不正确的是( )
| A. | 黄河入海口沙洲的形成与用卤水点豆腐,都体现了胶体聚沉的性质 | |
| B. | “煤改气”“煤改电”等清洁燃料改造工程有利于减少雾霾天气 | |
| C. | 利用二氧化碳等原料合成聚碳酸酯类可降解塑料,有利于减少白色污染 | |
| D. | 焰火的五彩缤纷是某些金属元素化学性质的展现 |
8.短周期元素X、Y、Z的原子序数依次递增,X与Y、Z位于相邻周期,X形成的常见含氧酸能氧化氢后金属,Y、Z原子最外层电子数之比为3:7,下列说法正确的是( )
| A. | X的常见氢化物水溶液显弱碱性 | |
| B. | 组成为HZO的物质结构式为H-Z-O | |
| C. | 最高价氧化物对应水化物酸性:Z>X>Y | |
| D. | 简单离子半径:Z>Y>X |
12.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 0.1mol Na2O2与足量的潮湿的二氧化碳反应转移的电子数为0.1NA | |
| B. | 1mol镁与足量O2或N2反应生成MgO或Mg3N2失去电子分别为2NA和3NA | |
| C. | 含NA个Na+的Na2O2溶于1L水中,Na+的物质的量浓度为1 mol/L | |
| D. | 某密闭容器中盛有0.2molN2和0.3molH2,在一定条件下充分反应,转移电子的数目为0.6 NA |
2.下列指定微粒的数目不相等的是( )
| A. | 钾和镁的次外层电子数 | |
| B. | 等质量的乙烯和丙烯中含有的共用电子对数 | |
| C. | 等体积的CO和NO含有的原子数 | |
| D. | 等物质的量的钠分别在常温下和点燃条件下与氧气反应转移的电子数 |
6.能源问题是人类社会面临的重大课题,甲醇是未来重要的绿色能源之一.
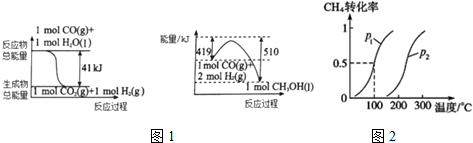
(1)利用工业废气CO2可制取甲醇,已知常温常压下下列反应的能量关系如图1:则CO2与H2反应生成液态CH3OH的热化学方程式为CO2(g)+3H2(g)=CH3OH(l)+H2O(l)△H=-50KJ/mol.
(2)CH4和H2O(g)通过下列转化也可以制得CH3OH:
I.CH4(g)+H2O(g)?CO(g)+3H2(g);△H1>0
Ⅱ.CO(g)+2H2(g)?CH3OH(g);△H2<0
将1.0molCH4和3.0molH2O(g)通入反应室(容积为100L)中,在一定条件下发生反应I,CH4的转化率与温度、压强的关系如图2所示.
①图中的p1<p2(填“<”、“>”或“=”),判断的理由是该反应正方向为体积增大的方向,相同温度下,压强越大甲烷的转化率减小,P2 的转化率比P1小,说明P2<P1.
②若反应Ⅱ在恒容密闭容器进行,下列能判断反应Ⅱ达到平衡状态的是cd(填序号).
a.生成CH3OH的速率与消耗CO的速率相等 b.混合气体的密度不变
c.混合气体的总物质的量不变 d.CH3OH、CO、H2的浓度都不再发生变化
③在某温度下,将一定量的CO和H2投入10L的密闭容器中发生反应II,5min时达到平衡,各物质的物质的浓度(mol•L-1)变化如下表所示:
若5min时只改变了某一条件,则所改变的条件是加了1mol氢气.

(1)利用工业废气CO2可制取甲醇,已知常温常压下下列反应的能量关系如图1:则CO2与H2反应生成液态CH3OH的热化学方程式为CO2(g)+3H2(g)=CH3OH(l)+H2O(l)△H=-50KJ/mol.
(2)CH4和H2O(g)通过下列转化也可以制得CH3OH:
I.CH4(g)+H2O(g)?CO(g)+3H2(g);△H1>0
Ⅱ.CO(g)+2H2(g)?CH3OH(g);△H2<0
将1.0molCH4和3.0molH2O(g)通入反应室(容积为100L)中,在一定条件下发生反应I,CH4的转化率与温度、压强的关系如图2所示.
①图中的p1<p2(填“<”、“>”或“=”),判断的理由是该反应正方向为体积增大的方向,相同温度下,压强越大甲烷的转化率减小,P2 的转化率比P1小,说明P2<P1.
②若反应Ⅱ在恒容密闭容器进行,下列能判断反应Ⅱ达到平衡状态的是cd(填序号).
a.生成CH3OH的速率与消耗CO的速率相等 b.混合气体的密度不变
c.混合气体的总物质的量不变 d.CH3OH、CO、H2的浓度都不再发生变化
③在某温度下,将一定量的CO和H2投入10L的密闭容器中发生反应II,5min时达到平衡,各物质的物质的浓度(mol•L-1)变化如下表所示:
| 2min | 5min | 10min | |
| CO | 0.07 | 0.06 | 0.05 |
| H2 | 0.14 | 0.12 | 0.20 |
| CH3OH | 0.03 | 0.04 | 0.05 |
7.下列有关实验原理或实验操作正确的是( )
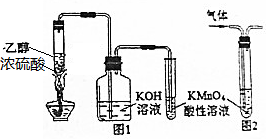

| A. | 用图1所示装置制取乙烯并验证其某些性质 | |
| B. | 用图2装置除去甲烷中的乙烯 | |
| C. | 在坩埚中灼烧CuSO4•5H2O晶体以除去结晶水 | |
| D. | 0.5g淀粉、5mL20%H2SO4和5mL蒸馏水混合,加热5min后冷却,然后向其中加入新制银氨溶液,水浴加热,无银镜反应,说明淀粉没有水解 |
 .
.