题目内容
15.ClO2是一种消毒杀菌效率高、二次污染小的水处理剂.实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2ClO2↑+K2SO4+2CO2↑+2H2O.下列说法中错误的是( )
| A. | KClO3在反应中得到电子 | |
| B. | ClO2中氯的化合价为+4价 | |
| C. | 在反应中H2C2O4是还原剂 | |
| D. | 1 mol KClO3参加反应有2mol电子转移 |
分析 2KClO3+H2C2O4+H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2ClO2↑+K2SO4+2CO2↑+2H2O(O均为-2价)中,Cl元素的化合价由+5价降低为+4价,C元素的化合价由+3价升高到+4价,以此来解答.
解答 解:A.Cl元素的化合价由+5价降低为+4价,所以氯酸钾得电子为氧化剂,故A正确;
B.ClO2中O为-2价,则氯的化合价为+4价,故B正确;
C.H2C2O4为还原剂,在反应中被氧化,故C正确;
D.1molKClO3参加反应有1mol×(5-4)=1mol,故D错误;
故选D.
点评 本题考查氧化还原反应,明确元素的化合价变化是解答本题的关键,并注意氧化剂、还原剂中元素的变化来解答,难度不大.

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目
5.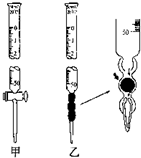 某学习小组用0.80mol/L标准浓度的烧碱溶液测定未知浓度的盐酸.
某学习小组用0.80mol/L标准浓度的烧碱溶液测定未知浓度的盐酸.
①用滴定的方法来测定盐酸的浓度,实验数据如表所示:
该未知盐酸的浓度为0.88mol•L-1(保留两位有效数字)
②滴定管如图所示,用乙滴定管盛装标准浓度的氢氧化钠溶液 (填“甲”或“乙”).
③下列操作会使所测得的盐酸的浓度偏低的是D.
A.盛装待测液的锥形瓶用水洗后未干燥
B.滴定前,碱式滴定管尖端有气泡,滴定后气泡消失
C.碱式滴定管用蒸馏水洗净后,未用标准氢氧化钠溶液润洗
D.读碱式滴定管的刻度时,滴定前仰视凹液面最低处,滴定后俯视读数.
 某学习小组用0.80mol/L标准浓度的烧碱溶液测定未知浓度的盐酸.
某学习小组用0.80mol/L标准浓度的烧碱溶液测定未知浓度的盐酸.①用滴定的方法来测定盐酸的浓度,实验数据如表所示:
| 实验编号 | 待测HCl溶液的体积/mL | 滴入NaOH溶液的体积/mL |
| 1 | 20.00 | 22.00 |
| 2 | 20.00 | 22.10 |
| 3 | 20.00 | 21.90 |
②滴定管如图所示,用乙滴定管盛装标准浓度的氢氧化钠溶液 (填“甲”或“乙”).
③下列操作会使所测得的盐酸的浓度偏低的是D.
A.盛装待测液的锥形瓶用水洗后未干燥
B.滴定前,碱式滴定管尖端有气泡,滴定后气泡消失
C.碱式滴定管用蒸馏水洗净后,未用标准氢氧化钠溶液润洗
D.读碱式滴定管的刻度时,滴定前仰视凹液面最低处,滴定后俯视读数.
3.下列实验操作中,所用仪器使用合理的是( )
| A. | 在容量瓶中溶解氢氧化钠固体并配制溶液 | |
| B. | 用100mL的量筒量取5.2mL的盐酸 | |
| C. | 用托盘天平称取25.2gNaCl | |
| D. | 用分液漏斗来过滤NaCl溶液中泥沙 |
10.能正确表示下列反应的离子方程式为( )
| A. | NH4HCO3溶于过量的浓KOH溶液中:NH4++HCO3-+2OH-═CO32-+NH3↑+2H2O | |
| B. | 碳酸钠溶液中加入澄清石灰水:Ca(OH)2+CO32-═CaCO3↓+2OH- | |
| C. | 稀硫酸中加入铁粉:2Fe+6H+═2Fe3++3H2↑ | |
| D. | 醋酸除去水垢:2H++CaCO3═Ca2++CO2↑+H2O |
7.某实验小组以粗镍(含少量Fe和Cr杂质)为原料制备Ni(NH3)6Cl2,并测定相关组分的含量.制备流程示意图如图.
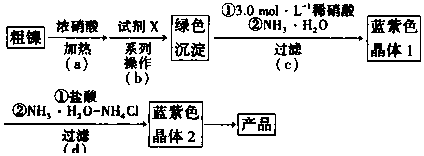
已知:①部分离子生成氢氧化物沉淀的pH(开始沉淀的pH按离子浓度为0.1mol•L-1计算)如表所示.
②Ni(OH)2为绿色难溶物.Ni(NH3)6(NO3)2、Ni(NH3)6Cl2均为可溶于水的蓝紫色晶体,水溶液均显碱性.
回答下列问题:
(1)实验需要配制3.0mol•L-1稀硝酸250mL.需要的玻璃仪器有烧杯、量筒、玻璃棒,胶头滴管和250mL容量瓶.
(2)步骤(a)中Ni和浓硝酸反应的化学方程式为Ni+4(浓)HNO3$\frac{\underline{\;\;△\;\;}}{\;}$Ni(NO3)2+2NO2↑+2H2O.
(3)步骤(b)首先加入试剂x调节溶液的pH约为6,过滤后再继续加入X调节pH以得到绿色沉淀.
①调节pH约为6的原因是使Cr3+、Fe3+完全沉淀,而Ni2+未开始沉淀
②试剂X可以是C(填标号).
A.H2SO4 B.Ni(OH)2 C.NaOH D.Fe2O3 E.NiO
(4)步骤(c)和(d)中的反应都需要在冰水浴环境下进行,其作用除了可以减少氨水的挥发.还有降低温度以降低产物的溶解度而析出
(5)NH3含量的测定.[已知:Ni(NH3)6Cl2+6HCl=NiCl2+6NH4Cl]
i.用电子天平称量mg产品于锥形瓶中,用25mL水溶解后加入5mL的6mol•L-1盐酸,以甲基橙作指示剂,滴定至终点消耗0.500 0mol•L-1 NaOH标准溶液V1mL.
ii.空白试验:不加入样品重复实验i.消耗NaOH标准溶液V2 mL.
①NH3的质量分数为$\frac{(V{\;}_{2}-V{\;}_{1})×10{\;}^{-3}×8.5}{m}$×100%.
②在上述方案的基础上,下列措施中能进一步提高测定准确度的有AD(填标号).
A.适当提高称量产品的质量 B.用H2SO4溶液替代盐酸C.用酚酞替代甲基橙 D.进行平行试验.

已知:①部分离子生成氢氧化物沉淀的pH(开始沉淀的pH按离子浓度为0.1mol•L-1计算)如表所示.
| Fe3+ | Cr3+ | Ni2+ | |
| 开始沉淀pH | 1.5 | 4.3 | 6.9 |
| 完全沉淀pH | 2.8 | 5.6 | 8.9 |
回答下列问题:
(1)实验需要配制3.0mol•L-1稀硝酸250mL.需要的玻璃仪器有烧杯、量筒、玻璃棒,胶头滴管和250mL容量瓶.
(2)步骤(a)中Ni和浓硝酸反应的化学方程式为Ni+4(浓)HNO3$\frac{\underline{\;\;△\;\;}}{\;}$Ni(NO3)2+2NO2↑+2H2O.
(3)步骤(b)首先加入试剂x调节溶液的pH约为6,过滤后再继续加入X调节pH以得到绿色沉淀.
①调节pH约为6的原因是使Cr3+、Fe3+完全沉淀,而Ni2+未开始沉淀
②试剂X可以是C(填标号).
A.H2SO4 B.Ni(OH)2 C.NaOH D.Fe2O3 E.NiO
(4)步骤(c)和(d)中的反应都需要在冰水浴环境下进行,其作用除了可以减少氨水的挥发.还有降低温度以降低产物的溶解度而析出
(5)NH3含量的测定.[已知:Ni(NH3)6Cl2+6HCl=NiCl2+6NH4Cl]
i.用电子天平称量mg产品于锥形瓶中,用25mL水溶解后加入5mL的6mol•L-1盐酸,以甲基橙作指示剂,滴定至终点消耗0.500 0mol•L-1 NaOH标准溶液V1mL.
ii.空白试验:不加入样品重复实验i.消耗NaOH标准溶液V2 mL.
①NH3的质量分数为$\frac{(V{\;}_{2}-V{\;}_{1})×10{\;}^{-3}×8.5}{m}$×100%.
②在上述方案的基础上,下列措施中能进一步提高测定准确度的有AD(填标号).
A.适当提高称量产品的质量 B.用H2SO4溶液替代盐酸C.用酚酞替代甲基橙 D.进行平行试验.
4. (1)根据VSEPR模型判断,下列微粒中所有原子都在同一平面上的一组是B.
(1)根据VSEPR模型判断,下列微粒中所有原子都在同一平面上的一组是B.
A、SO32-和NO2-B、NO3-和SO3
C、H3O+和ClO3-D、PO43-和SO32-
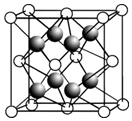
(2)CaF2的晶胞如图所示.
①下列有关CaF2的表达正确的是bd.
a.Ca2+与F-间仅存在静电吸引作用
b.F-的离子半径小于Cl-,则CaF2的熔点高于CaCl2
c.阴、阳离子比为2:1的离子化合物,均与CaF2晶体构型相同
d.CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电
②CaF2难溶于水,但可溶于含Al3+的溶液中,原因是3CaF2+Al3+=[AlF6]3-+3Ca2+ (用离子方程式表示,已知[AlF6]3-在溶液中可稳定存在).
③晶胞中F-的配位数是4,与一个Ca2+等距离且最近的Ca2+有12个.
(3)铜、锌两种元素的第一电离能、第二电离能如表所示
④写出Cu原子核外电子排布式[Ar]3d104s1;
⑤铜的第一电离能(I1)小于锌的第一电离能,而铜的第二电离能(I2)却大于锌的第二电离能,其主要原因是Cu原子失去一个电子后,核外电子排布为[Ar]3d10,而锌为[Ar]3d104s1,根据洪特规则,铜达到了较稳定状态,所以Cu的第二电离能相对较大.
 (1)根据VSEPR模型判断,下列微粒中所有原子都在同一平面上的一组是B.
(1)根据VSEPR模型判断,下列微粒中所有原子都在同一平面上的一组是B.A、SO32-和NO2-B、NO3-和SO3
C、H3O+和ClO3-D、PO43-和SO32-
(2)CaF2的晶胞如图所示.
①下列有关CaF2的表达正确的是bd.
a.Ca2+与F-间仅存在静电吸引作用
b.F-的离子半径小于Cl-,则CaF2的熔点高于CaCl2
c.阴、阳离子比为2:1的离子化合物,均与CaF2晶体构型相同
d.CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电
②CaF2难溶于水,但可溶于含Al3+的溶液中,原因是3CaF2+Al3+=[AlF6]3-+3Ca2+ (用离子方程式表示,已知[AlF6]3-在溶液中可稳定存在).
③晶胞中F-的配位数是4,与一个Ca2+等距离且最近的Ca2+有12个.
(3)铜、锌两种元素的第一电离能、第二电离能如表所示
| 电离能/kJ•mol-1 | I1 | I2 |
| 铜 | 746 | 1958 |
| 锌 | 906 | 1733 |
⑤铜的第一电离能(I1)小于锌的第一电离能,而铜的第二电离能(I2)却大于锌的第二电离能,其主要原因是Cu原子失去一个电子后,核外电子排布为[Ar]3d10,而锌为[Ar]3d104s1,根据洪特规则,铜达到了较稳定状态,所以Cu的第二电离能相对较大.
17.某同学用中和滴定法测定某烧碱的纯度,实验过程如下:
(1)配制待测液:称取4.1g固体烧碱样品(杂质不与酸反应)配制成250mL溶液.
(2)滴定
①用碱式滴定管量取10.00mL待测液.
②向锥形瓶中加入几滴酚酞,用0.201 0mol•L-1的标准盐酸滴定待测烧碱溶液,边滴边摇动锥形瓶,眼睛注视锥形瓶内溶液颜色的变化,直到锥形瓶中溶液颜色的变化;溶液由红色变为无色,且半分钟内不恢复时停止滴定.
(3)数据处理
根据上述表格,选取合适的数据,计算待测烧碱溶液的浓度为0.4020mol•L-1,烧碱的纯度为98.05%(保留两位小数).
(4)一定物质的量浓度溶液的配制和酸碱中和滴定是中学化学中两个典型的定量实验.某研究性学习小组在实验室中配制盐酸标准溶液,然后用其滴定某未知浓度的NaOH溶液.下列有关说法中正确的是(多选)ABDH
A.实验中所用到的滴定管、容量瓶,在使用前均需要检漏
B.如果实验中需用80mL的稀盐酸标准溶液,配制时应选用100mL容量瓶
C.容量瓶中含有少量蒸馏水,会导致所配标准溶液的浓度偏小
D.酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀盐酸,则测得的NaOH溶液的浓度将偏大
E.配制溶液时,定容时俯视读数,则导致实验结果偏大
F.中和滴定时,若在最后一次读数时俯视读数,则导致实验结果偏大
G.锥形瓶用蒸馏水洗浄后,有少量蒸馏水残留,则导致实验结果偏小
H.滴定前滴定管尖嘴有气泡,滴定后气泡消失,则导致实验结果偏大.
(1)配制待测液:称取4.1g固体烧碱样品(杂质不与酸反应)配制成250mL溶液.
(2)滴定
①用碱式滴定管量取10.00mL待测液.
②向锥形瓶中加入几滴酚酞,用0.201 0mol•L-1的标准盐酸滴定待测烧碱溶液,边滴边摇动锥形瓶,眼睛注视锥形瓶内溶液颜色的变化,直到锥形瓶中溶液颜色的变化;溶液由红色变为无色,且半分钟内不恢复时停止滴定.
(3)数据处理
| 实验次 序编号 | 盐酸溶液体积 V/mL | 氢氧化钠溶液体积 V/mL |
| 1 | 19.90 | 10.00 |
| 2 | 20.10 | 10.00 |
| 3 | 22.00 | 10.00 |
| 4 | 20.00 | 10.00 |
(4)一定物质的量浓度溶液的配制和酸碱中和滴定是中学化学中两个典型的定量实验.某研究性学习小组在实验室中配制盐酸标准溶液,然后用其滴定某未知浓度的NaOH溶液.下列有关说法中正确的是(多选)ABDH
A.实验中所用到的滴定管、容量瓶,在使用前均需要检漏
B.如果实验中需用80mL的稀盐酸标准溶液,配制时应选用100mL容量瓶
C.容量瓶中含有少量蒸馏水,会导致所配标准溶液的浓度偏小
D.酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀盐酸,则测得的NaOH溶液的浓度将偏大
E.配制溶液时,定容时俯视读数,则导致实验结果偏大
F.中和滴定时,若在最后一次读数时俯视读数,则导致实验结果偏大
G.锥形瓶用蒸馏水洗浄后,有少量蒸馏水残留,则导致实验结果偏小
H.滴定前滴定管尖嘴有气泡,滴定后气泡消失,则导致实验结果偏大.
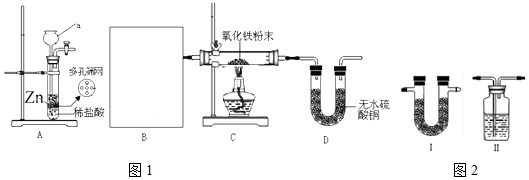
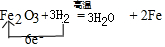 .实验结束时应该采取的操作是先停止加热,冷却到室温,再停止通H2.
.实验结束时应该采取的操作是先停止加热,冷却到室温,再停止通H2.