题目内容
10.能正确表示下列反应的离子方程式为( )| A. | NH4HCO3溶于过量的浓KOH溶液中:NH4++HCO3-+2OH-═CO32-+NH3↑+2H2O | |
| B. | 碳酸钠溶液中加入澄清石灰水:Ca(OH)2+CO32-═CaCO3↓+2OH- | |
| C. | 稀硫酸中加入铁粉:2Fe+6H+═2Fe3++3H2↑ | |
| D. | 醋酸除去水垢:2H++CaCO3═Ca2++CO2↑+H2O |
分析 A.氢氧化钾过量,铵根离子、碳酸氢根离子都反应;
B.澄清石灰水中氢氧化钙应拆成离子形式;
C.不符合反应客观事实;
D.醋酸为弱酸,应保留 化学式.
解答 解:A.NH4HCO3溶于过量的浓KOH溶液中,离子方程式:NH4++HCO3-+2OH-═CO32-+NH3↑+2H2O,故A正确;
B.碳酸钠溶液中加入澄清石灰水,离子方程式:Ca2++CO32-═CaCO3↓,故B错误;
C.稀硫酸中加入铁粉,离子方程式:Fe+2H+═Fe2++H2↑,故C错误;
D.醋酸除去水垢,离子方程式:2CH3COOH+CaCO3═Ca2++CO2↑+H2O+2CH3COO-,故D错误;
故选:A.
点评 本题考查了离子方程式的书写,明确反应实质及离子方程式书写方法是解题关键,注意化学式的拆分,题目难度不大.

练习册系列答案
 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案
相关题目
6.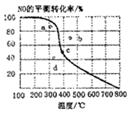 如图中曲线为一定压强下NO的平衡转化率与温度的关系,图中a、b、c、d四点表示不同温度、压强下2NO(g)+O2(g)?2NO2(g)达到平衡时NO的转化率,则压强最大的点为( )
如图中曲线为一定压强下NO的平衡转化率与温度的关系,图中a、b、c、d四点表示不同温度、压强下2NO(g)+O2(g)?2NO2(g)达到平衡时NO的转化率,则压强最大的点为( )
 如图中曲线为一定压强下NO的平衡转化率与温度的关系,图中a、b、c、d四点表示不同温度、压强下2NO(g)+O2(g)?2NO2(g)达到平衡时NO的转化率,则压强最大的点为( )
如图中曲线为一定压强下NO的平衡转化率与温度的关系,图中a、b、c、d四点表示不同温度、压强下2NO(g)+O2(g)?2NO2(g)达到平衡时NO的转化率,则压强最大的点为( )| A. | a | B. | b | C. | c | D. | d |
1.在中和滴定中,下列操作或说法不正确的是( )
| A. | 使用滴定管时,滴定管必须用待装液润洗2~3次 | |
| B. | 酸式滴定管不能盛装碱液,碱式滴定管不能盛装酸液 | |
| C. | 盛放准确量取待测液的锥形瓶应预先用待测液润洗 | |
| D. | 滴定操作应重复2至3次,并求出滴定用去的溶液体积的平均值,计算出待测液的浓度 |
15.ClO2是一种消毒杀菌效率高、二次污染小的水处理剂.实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2ClO2↑+K2SO4+2CO2↑+2H2O.
下列说法中错误的是( )
下列说法中错误的是( )
| A. | KClO3在反应中得到电子 | |
| B. | ClO2中氯的化合价为+4价 | |
| C. | 在反应中H2C2O4是还原剂 | |
| D. | 1 mol KClO3参加反应有2mol电子转移 |
2. 人工肾脏可用间接电化学方法除去代谢产物中的尿素[CO(NH2)2],原理如图.下列有关说法正确的是( )
人工肾脏可用间接电化学方法除去代谢产物中的尿素[CO(NH2)2],原理如图.下列有关说法正确的是( )
 人工肾脏可用间接电化学方法除去代谢产物中的尿素[CO(NH2)2],原理如图.下列有关说法正确的是( )
人工肾脏可用间接电化学方法除去代谢产物中的尿素[CO(NH2)2],原理如图.下列有关说法正确的是( )| A. | A为电源的负极 | |
| B. | 电解结束后,阴极室溶液的pH与电解前相比将不变 | |
| C. | 阳极室中发生的电极反应为2H++2e-═H2↑ | |
| D. | 若两极共收集到气体13.44 L(标准状况),则除去的尿素为18g(忽略气体的溶解) |
12.已知Ksp(AB2)=4.2×10-8,Ksp(AC)=3.0×10-15.在AB2、AC均为饱和的混合液中,测得c(B-)=1.6×10-3 mol•L-1,则溶液中c(C2-)为( )
| A. | 1.8×10-13 mol•L-1 | B. | 7.3×10-13 mol•L-1 | ||
| C. | 2.3 mol•L-1 | D. | 3.7 mol•L-1 |
 ,该反应属于取代(填“取代”或“加成”)反应.
,该反应属于取代(填“取代”或“加成”)反应.