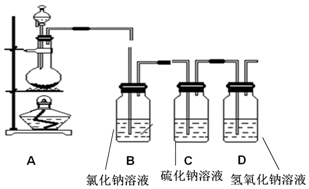
题目内容
3.在标准状况下,将6.72LH2S和6.72LO2混合引燃,待反应完全后,恢复至标况下,把气体通入到NaOH溶液中,得到盐的质量是( )| A. | 25.2g | B. | 18.9g | C. | 23.4g | D. | 48.6g |
分析 依据方程式:2H2S+O2(少量)$\frac{\underline{\;点燃\;}}{\;}$2S+2H2O,S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2,2NaOH+SO2=Na2SO3+H2O计算解答.
解答 解:n(H2S)=$\frac{6.72L}{22.4L/mol}$=0.3mol,n(O2)=$\frac{6.72L}{22.4L/mol}$=0.3mol,注意计算时应该以不足的作为计算对象,
2H2S+O2(少量)$\frac{\underline{\;点燃\;}}{\;}$2S+2H2O
2 1 2
0.3 n 0.3
$\frac{2}{0.3}=\frac{1}{n}$,解得n=0.15mol,则n剩(O2)=0.3mol-0.15mol=0.15mol,
S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2
1 1
0.15 0.15故生成SO2 0.15mol,
2NaOH+SO2=Na2SO3+H2O
1 126
0.15 m
$\frac{1}{0.15}=\frac{126}{m}$,解得m=18.9g,
故选B.
点评 明确硫及其化合物性质,以及正确书写方程式是解题的关键,并明确在化学反应计算中应该以不足的作为计算对象,题目难度中等.

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案
相关题目
14.下列叙述正确的是( )
| A. | 直径介于1nm~100nm之间的微粒称为胶体 | |
| B. | 电泳现象可证明胶体带电 | |
| C. | 渗析法可用于含有氯化钠的淀粉溶液的提纯 | |
| D. | 用含1molFeCl3的溶液可制得6.02×1023个Fe(OH)3胶体粒子 |
8.图是298K 时N2与H2反应过程中能量变化的曲线图.下列叙述正确的是( )
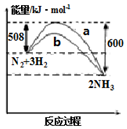

| A. | 该反应的热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=92kJ•mol-1 | |
| B. | b曲线是升高温度时的能量变化曲线 | |
| C. | 加入催化剂,该化学反应的活化能和反应热都改变 | |
| D. | 在温度体积一定的条件下,通入lmol N2和3molH2 反应后放出的热量为Q1kJ,若通入2mol N2和6mol H2 反应后放出的热量为Q2kJ,则184>Q2>2Q1 |
15.已知 X、Y 为第三周期非金属元素(稀有气体除外),且电负性 X>Y,下列说法错误的 是( )
| A. | X 与 Y 形成化合物时,X 可能显负价,也可能显正价 | |
| B. | 第一电离能 X 可能小于 Y | |
| C. | X 的最高价含氧酸的酸性强于 Y 的最高价含氧酸的酸性 | |
| D. | 原子序数 X 一定大于 Y |
8.温度为T时,向2.0L恒容密闭容器中充入1.0molPCl5,反应PCl5(g)?PCl3(g)+Cl2(g)经一段时间后达到平衡.反应过程中测定的部分数据见表:
下列说法不正确的是( )
| t | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | 反应在前50s的平均速率为v(PCl3)=0.001 6 mol•L-1•s-1 | |
| B. | 保持其他条件不变,升高温度,平衡时,c(PCl3)=0.11 mol•L-1,则反应的△H>0 | |
| C. | 相同温度下,起始时向容器中充入1.0 molPCl5、0.20 molPCl3和0.20 molCl2,达到平衡前v(正)>v(逆) | |
| D. | 相同温度下,起始时向容器中充入2.0 molPCl3、2.0 molCl2,达到平衡时,PCl3的转化率大于80% |