题目内容
15.已知 X、Y 为第三周期非金属元素(稀有气体除外),且电负性 X>Y,下列说法错误的 是( )| A. | X 与 Y 形成化合物时,X 可能显负价,也可能显正价 | |
| B. | 第一电离能 X 可能小于 Y | |
| C. | X 的最高价含氧酸的酸性强于 Y 的最高价含氧酸的酸性 | |
| D. | 原子序数 X 一定大于 Y |
分析 X、Y 为第三周期非金属元素(稀有气体除外),且电负性 X>Y,可知非金属性 X>Y,同周期从左向右非金属性增强,非金属性越强,对应最高价含氧酸的酸性越强,以此啦解答.
解答 解:A.非金属性 X>Y,X 与 Y 形成化合物时,X显负价,故A错误;
B.非金属性 X>Y,若X为P,Y为S,P的3p电子半满为稳定结构,则第一电离能 X 大于 Y;若X为S,Y为Cl,第一电离能 X 小于 Y,故B正确;
C.非金属性 X>Y,X 的最高价含氧酸的酸性强于 Y 的最高价含氧酸的酸性,故C正确;
D.同周期从左向右非金属性增强,非金属性越强,可知原子序数 X 一定大于 Y,故D正确;
故选A.
点评 本题考查原子结构与元素周期律,为高频考点,把握同周期元素的性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,选项B为解答的难点,题目难度不大.

练习册系列答案
相关题目
6.设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 0.5molCl2通入足量水中充分反应.转移的电子数等于0.5NA | |
| B. | 46gNO2和N2O4混合气体中含有原子总数为3NA | |
| C. | 标准状况下,22.4LSO3中含有的分子数为NA. | |
| D. | 1L0.1mol/L的NaHSO3溶液中,HSO32-、SO32-的离子数之和为0.1NA |
3.在标准状况下,将6.72LH2S和6.72LO2混合引燃,待反应完全后,恢复至标况下,把气体通入到NaOH溶液中,得到盐的质量是( )
| A. | 25.2g | B. | 18.9g | C. | 23.4g | D. | 48.6g |
10.下列说法正确的是( )
| A. | 1.0mol的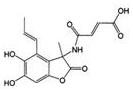 与NaOH溶液和H 2反应时,分别需要消耗NaOH 6.0mol和H 25.0mol 与NaOH溶液和H 2反应时,分别需要消耗NaOH 6.0mol和H 25.0mol | |
| B. | 乙醇、乙酸和乙酸乙酯不能用饱和Na 2CO 3溶液鉴别 | |
| C. | 桶烯(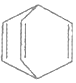 )与苯乙烯 )与苯乙烯 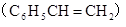 互为同分异构体,均属于芳香烃 互为同分异构体,均属于芳香烃 | |
| D. | 按系统命名法,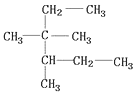 的名称为3,3二甲基2乙基戊烷 的名称为3,3二甲基2乙基戊烷 |
20.下列说法正确的是( )
| A. | 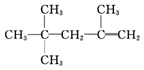 的名称为2,2,4-三甲基-4-戊烯 的名称为2,2,4-三甲基-4-戊烯 | |
| B. | 化合物 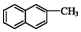 不是苯的同系物 不是苯的同系物 | |
| C. | 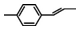 分子中所有碳原子一定共平面 分子中所有碳原子一定共平面 | |
| D. | 除甲酸外的羧酸均不能使高锰酸钾酸性溶液褪色 |
7.某溶液中含有HCO3-、SO32-、CO32-、CH3COO-等4种阴离子.向其中加入足量的Na2O2固体后,溶液中离子浓度明显增加的是(假设溶液体积无变化)( )
| A. | CH3COO- | B. | SO32- | C. | CO32- | D. | HCO3- |
4.R、Q为短周期中的两种元素,R元素原子的最外层电子数与次外层电子数之差的绝对值等于电子层数;Q元素原子的最外层电子数是次外层电子数的3倍,则下列叙述中肯定不正确的是( )
| A. | 原子半径:R>Q | B. | R和Q可形成离子化合物R2Q5 | ||
| C. | R和Q可形成共价化合物RQ | D. | R和Q可形成共价化合物RQ2 |