题目内容
11.某消毒液的主要成分为 NaClO(混有少量 NaCl),请用相应的化学用语来解释下列事实.(1)该消毒液可用NaOH溶液吸收 Cl2制备,化学方程式为Cl2+NaOH═NaCl+NaClO+H2O.
(2)向 FeSO4 溶液中滴入少量该溶液,溶液颜色变成棕黄色,反应的离子方程式为:2Fe2++ClO-+2H+═Cl-+2Fe3++H2O.
(3)该消毒液不能与洁厕灵(主要成分为浓盐酸)混用,否则会产生中毒危险.若将二者混合,每产生 1mol Cl2,转移电子个数约为6.02×1023或NA.
分析 (1)氯气与NaOH反应生成氯化钠、次氯酸钠和水;
(2)发生氧化还原反应生成铁离子,溶液为黄色;
(3)消毒液不能与洁厕灵(主要成分为浓盐酸)混用,发生NaClO+2HCl=NaCl+Cl2↑+H2O,以此计算.
解答 解:(1)氯气与NaOH反应生成氯化钠、次氯酸钠和水,反应为Cl2+2NaOH═NaCl+NaClO+H2O,故答案为:Cl2+NaOH═NaCl+NaClO+H2O;
(2)发生氧化还原反应生成铁离子,溶液为黄色,离子反应方程式为2Fe2++ClO-+2H+═Cl-+2Fe3++H2O,故答案为:2Fe2++ClO-+2H+═Cl-+2Fe3++H2O;
(3)消毒液不能与洁厕灵(主要成分为浓盐酸)混用,发生NaClO+2HCl=NaCl+Cl2↑+H2O,由Cl元素的化合价变化可知,生成1mol氯气转移1mol电子,转移电子个数为6.02×1023或NA,
故答案为:6.02×1023或NA.
点评 本题考查物质的性质,为高频考点,把握物质的性质、发生的反应、氧化还原反应等为解答的关键,侧重分析与应用能力的考查,注意氧化还原反应的应用,题目难度不大.

练习册系列答案
相关题目
1.硫铁矿烧渣是硫铁矿生产硫酸过程中产生的工业废渣(主要含Fe2O3及少量SiO2、Al2O3、CaO、MgO等杂质).用该烧渣制取药用辅料--红氧化铁的工艺流程如下:
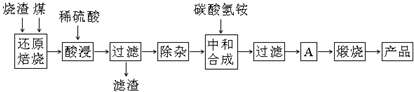
(1)在“还原焙烧”中产生的有毒气体可能有CO、SO2等.
(2)“酸浸”时间一般不超过20min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因用离子方程式表示:4Fe2++O2+4H+=4Fe3++2H2O.
(3)根据下表数据:
在“除杂”步骤中,为除去Fe3+和Al3+,溶液的pH最大值应小于7.11,当pH=5时,溶液中c(Al3+)为2.0×10-6mol•L-1(已知常温下Ksp[Al(OH)3]=2.0×10-33).
(4)“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,碳酸氢铵与硫酸亚铁反应的离子方程式为Fe2++2HCO3-=FeCO3↓+CO2↑+H2O.若用等物质的量的碳酸铵替代碳酸氢铵,则产品中可能混有的杂质是CaO、MgO.
(5)A的操作是洗涤、干燥.
(6)m g烧渣经过上述工艺可得红氧化铁n g.药典标准规定,制得的红氧化铁中含氧化铁不得少于98.0%,则所选用的烧渣中铁的质量分数应不低于$\frac{n×98%×56}{80m}$(用含m、n的表达式表示).

(1)在“还原焙烧”中产生的有毒气体可能有CO、SO2等.
(2)“酸浸”时间一般不超过20min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因用离子方程式表示:4Fe2++O2+4H+=4Fe3++2H2O.
(3)根据下表数据:
| 氢氧化物 | Al(OH)3 | Mg(OH)2 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 3.10 | 8.54 | 2.01 | 7.11 |
| 完全沉淀的pH | 4.77 | 11.04 | 3.68 | 9.61 |
(4)“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,碳酸氢铵与硫酸亚铁反应的离子方程式为Fe2++2HCO3-=FeCO3↓+CO2↑+H2O.若用等物质的量的碳酸铵替代碳酸氢铵,则产品中可能混有的杂质是CaO、MgO.
(5)A的操作是洗涤、干燥.
(6)m g烧渣经过上述工艺可得红氧化铁n g.药典标准规定,制得的红氧化铁中含氧化铁不得少于98.0%,则所选用的烧渣中铁的质量分数应不低于$\frac{n×98%×56}{80m}$(用含m、n的表达式表示).
6.设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 0.5molCl2通入足量水中充分反应.转移的电子数等于0.5NA | |
| B. | 46gNO2和N2O4混合气体中含有原子总数为3NA | |
| C. | 标准状况下,22.4LSO3中含有的分子数为NA. | |
| D. | 1L0.1mol/L的NaHSO3溶液中,HSO32-、SO32-的离子数之和为0.1NA |
3.在标准状况下,将6.72LH2S和6.72LO2混合引燃,待反应完全后,恢复至标况下,把气体通入到NaOH溶液中,得到盐的质量是( )
| A. | 25.2g | B. | 18.9g | C. | 23.4g | D. | 48.6g |
20.下列说法正确的是( )
| A. | 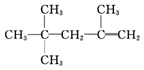 的名称为2,2,4-三甲基-4-戊烯 的名称为2,2,4-三甲基-4-戊烯 | |
| B. | 化合物 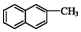 不是苯的同系物 不是苯的同系物 | |
| C. | 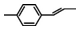 分子中所有碳原子一定共平面 分子中所有碳原子一定共平面 | |
| D. | 除甲酸外的羧酸均不能使高锰酸钾酸性溶液褪色 |
1.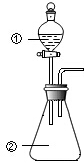 用图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
用图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
 用图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
用图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( ) | 选项 | ①中物质 | ②中物质 | 预测②中的现象 |
| A | 浓盐酸 | MnO2 | 产生黄绿色气体 |
| B | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
| C | 酸化的FeCl2溶液 | H2O2溶液 | 溶液变成黄棕色,有气泡产生 |
| D | Fe2(SO4)3溶液 | 铜粉 | 溶液变蓝色,有黑色固体产生 |
| A. | A | B. | B | C. | C | D. | D |




 .C与氢元素可分别形成含10个电子的分子、阴离子和阳离子,阳离子中中心原子的杂化类型为sp3
.C与氢元素可分别形成含10个电子的分子、阴离子和阳离子,阳离子中中心原子的杂化类型为sp3